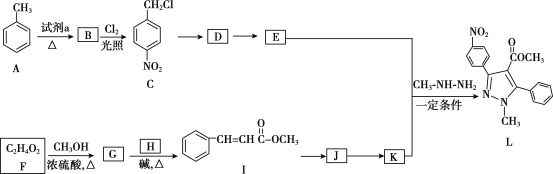
题目内容
【题目】新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为_____,该能层具有的原子轨道数为_____.
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是_____,B原子的杂化轨道类型是_____.
Li、B、H元素的电负性由大到小排列顺序为_____.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+_____H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
I1/kJmol﹣1 | I2/kJmol﹣1 | I3/kJmol﹣1 | I4/kJmol﹣1 | I5/kJmol﹣1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____(填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为_____,NaH的理论密度是___________gcm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
【答案】M 9 正四面体 sp3 H>B>Li < Mg 142pm ![]()
【解析】
(1)①Cl原子核外电子数为17,基态原子核外电子排布为1s22s22p63s23p5,据此解答;
②根据价层电子对互斥理论确定离子空间构型、B原子的杂化轨道类型;元素的非金属性越强,其电负性越大;
(2)①核外电子排布相同的离子,核电荷数越大,离子半径越小;
②该元素的第III电离能剧增,则该元素属于第IIA族;
(3)NaH具有NaCl型晶体结构,食盐晶体里Na+和Cl﹣的间距为棱长的一半,据此分析解答。
(1)①基态Cl原子中电子占据的最高能层为第3能层,符号M,该能层有1个s轨道、3个p轨道、5个d轨道,共有9 个原子轨道,
故答案为M;9;
②BH4﹣中B原子价层电子数=4+![]() =4,B原子的杂化轨道类型是sp3杂化,且不含孤电子对,所以是正四面体构型,非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li,
=4,B原子的杂化轨道类型是sp3杂化,且不含孤电子对,所以是正四面体构型,非金属的非金属性越强其电负性越大,非金属性最强的是H元素,其次是B元素,最小的是Li元素,所以Li、B、H元素的电负性由大到小排列顺序为H>B>Li,
故答案为正四面体;sp3;H>B>Li;
(2)①核外电子排布相同,核电荷数越大,离子半径越小,锂的质子数为3,氢的质子数为1,Li+、H﹣核外电子数都为2,所以半径Li+<H﹣,
故答案为<;
②该元素的第III电离能剧增,则该元素属于第IIA族,为Mg元素,
故答案为Mg;
(3)NaH具有NaCl型晶体结构,NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为![]() =142pm,该晶胞中钠离子个数=8×
=142pm,该晶胞中钠离子个数=8×![]() +6×
+6×![]() =4,氢离子个数=12×
=4,氢离子个数=12×![]() +1=4,NaH的理论密度是ρ=
+1=4,NaH的理论密度是ρ=![]()
![]()
,
故答案为142pm;![]() 。
。