题目内容
【题目】CO、NO、NO2、SO2等有毒气体会危害人体健康,破坏环境,对其进行无害处理研究一直是科技界关注的重点。请回答以下问题:
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式__。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,若反应达到平衡时,所得的混合气体中含N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,若反应达到平衡时,所得的混合气体中含N2的体积分数随![]() 的变化曲线如图1。
的变化曲线如图1。

①a、b、c、d四点的平衡常数从大到小的顺序为__。
②若![]() =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为__。
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为__。
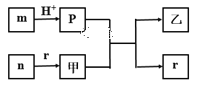
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为__,经过一段时间后,若乙中需加0.1molCu2(OH)2CO3可使溶液复原,则转移的电子数为__NA。
(4)常温下,SO2可以用碱溶液吸收处理。若将SO2通入到NaOH溶液中,充分反应后得到amol·L-1的NaHSO3溶液,该溶液的pH=5,则该溶液中c(SO32-)___c(H2SO3)(填“>”、“=”或“<”),HSO3-的电离常数约为___(用含a的式子表示)。
【答案】4CO(g)+2NO2(g)=4CO2(g)+N2(g) ΔH=-1227.8kJ·mol-1 a=b=c>d 60% NO2-e-+H2O=NO3-+2H+ 0.6 > ![]()
【解析】
(1)由CO和NO2生成无污染气体,则产物为CO2和N2;根据盖斯定律进行计算;
(2)①根据外界条件对平衡移动的影响规律进行分析,平衡常数只与温度有关;
②气体的体积分数之比等于气体的物质的量之比,根据三段式列式进行计算,从而求出NO的转化率;
(3)D电极上有红色物质析出,说明在D电极上Cu2+得到电子被还原为Cu,说明D电极为阴极,则A电极为负极,发生氧化反应,据此规律写出极反应方程式;由于加0.1molCu2(OH)2CO3使溶液复原,相当于电解完Cu2+后又电解了H2O,据此计算电子转移的数目;
(4)NaHSO3溶液的pH=5,说明![]() 的电离大于水解,溶液显酸性;NaHSO3溶液的浓度为amol·L-1,
的电离大于水解,溶液显酸性;NaHSO3溶液的浓度为amol·L-1,![]() ,pH=5,
,pH=5,![]() ,根据
,根据![]() 进行计算。
进行计算。
(1)由CO和NO2生成无污染气体,则产物为CO2和N2,方程式为4CO(g)+2NO2(g)=4CO2(g)+N2(g),该反应可由①-③+4×②得到,由盖斯定律可得该反应的![]() ;
;
(2)①反应2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1为放热反应,温度越高,N2平衡时的体积分数越小,由图可知T1>T2,由于正反应放热,温度越高,平衡向逆向移动,平衡常数越小,相同温度下平衡常数相同,固有a=b=c>d;
N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1为放热反应,温度越高,N2平衡时的体积分数越小,由图可知T1>T2,由于正反应放热,温度越高,平衡向逆向移动,平衡常数越小,相同温度下平衡常数相同,固有a=b=c>d;
②设起始时NO的物质的量为a,则CO的物质的量为0.8a,反应的N2的物质的量为![]() ,由题意得
,由题意得
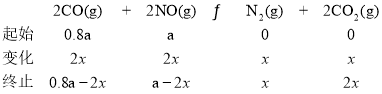
![]() ,解得
,解得![]() =0.3a,故NO的转化率为
=0.3a,故NO的转化率为![]() ;
;
(3)D电极上有红色物质析出,说明在D电极上Cu2+得到电子被还原为C'u,说明D电极为阴极,则A电极为负极,发生氧化反应,所以A电极通入NO2,发生电极反应为: NO2-e-+H2O=NO3-+2H+,乙中阴极发生反应:Cu2++2e-=Cu,H2O+2e-=H2↑+2OH-,阳极发生反应:2H2O-4e-=2O2↑+4H+,由于加0.1molCu2(OH)2CO3使溶液复原,相当于电解完Cu2+后又电解了H2O,电解Cu2+转移电子数为0.2×2=0.4NA,电解H2O转移电子数为0.2NA,共转移电子0.6 NA;
(4)NaHSO3溶液的pH=5,说明![]() 的电离大于水解,故c(SO3
的电离大于水解,故c(SO3![]() 的电离平衡为:
的电离平衡为:![]() ,NaHSO3溶液的浓度为amol·L-1,
,NaHSO3溶液的浓度为amol·L-1,![]() ,pH=5,
,pH=5,![]() ,所以
,所以![]() 。
。

【题目】在800℃时,2L密闭容器内发生反应:2NO(g)+O2(g)2NO2(g),反应体系中,一氧化氮的物质的量随时间的变化如表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示NO2的物质的量浓度变化的曲线是________。

(2)用O2表示从0~2 s内该反应的平均速率v=__________。
(3)能说明该反应已达到平衡状态的是________。
A.v(NO2)=2v(O2)
B.容器内压强保持不变
C.容器内气体质量不变
D.容器内密度保持不变
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 为短周期元素,其原子半径、化合价等信息见下表。以下说法一定正确的是( )
为短周期元素,其原子半径、化合价等信息见下表。以下说法一定正确的是( )
元素 |
|
|
|
|
原子半径( | 0.077 | 0.070 | 0.104 | 0.099 |
最高正价或最低负价 | +4 | +5 | -2 | -1 |
A.![]() 与
与![]() 形成的化合物的电子式可表示为
形成的化合物的电子式可表示为![]()
B.![]() 的氢化物能与
的氢化物能与![]() 的氢化物反应,所得产物只含有共价键
的氢化物反应,所得产物只含有共价键
C.![]() 、
、![]() 能分别与氧元素形成多种氧化物
能分别与氧元素形成多种氧化物
D.![]() 处于元素同期中第三周期ⅣA族
处于元素同期中第三周期ⅣA族