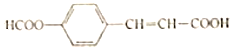
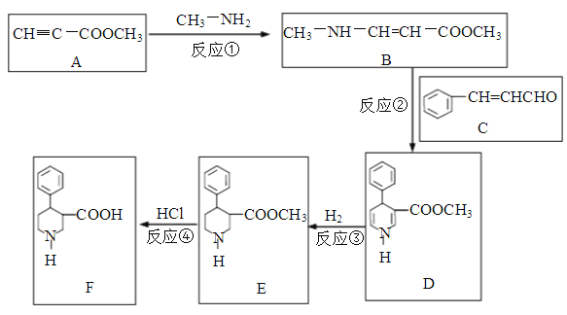
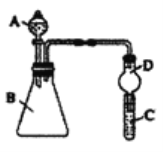
题目内容
【题目】将水分解制得氢气的一种工业方法是“硫﹣碘循环法”,依次涉及下列三步反应:
I.SO2+2H2O+I2=H2SO4+2HI
II.2HI(g)H2(g)+I2(g)
III.2H2SO4=2SO2+O2+2H2O
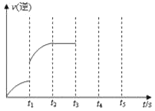
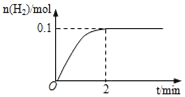
(1)一定温度下,向5L恒容密闭容器中加入1molHI,发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)=___。相同温度下,若起始加入的HI改为2mol,反应达平衡时H2的量为___mol。
(2)分析上述反应,下列判断错误的是___(填写选项编号,只有一个正确选项)。
a.三步反应均为氧化还原反应
b.循环过程中产生1molH2,同时产生1molO2
c.在整个分解水的过程中SO2和I2相当于催化剂
【答案】0.02moL/(Lmin) 0.2 b
【解析】
(1)由图可知,平衡时氢气的物质的量为0.1mol,根据方程式计算参加反应的HI的物质的量,可计算v(HI);恒温恒容条件下,若起始加入的HI改为2mol,相当于增大压强,平衡不移动,反应达平衡时H2的量为原平衡的2倍;
(2)总反应为2H2O![]() 2H2+O2,整个分解水的过程中SO2和I2相当于催化剂。
2H2+O2,整个分解水的过程中SO2和I2相当于催化剂。
(1)方程式为2HI(g)H2(g)+I2(g),平衡时氢气的物质的量为0.1mol,则消耗0.2molHI,0~2min内的平均反应速率v(HI)= =0.02moL/(Lmin);恒温恒容条件下,若起始加入的HI改为2mol,相当于增大压强,平衡不移动,反应达平衡时H2的量为原平衡的2倍,应为0.2mol;
=0.02moL/(Lmin);恒温恒容条件下,若起始加入的HI改为2mol,相当于增大压强,平衡不移动,反应达平衡时H2的量为原平衡的2倍,应为0.2mol;
故答案为:0.02moL/(Lmin);0.2;
(2)a.三步反应都涉及到单质,存在元素化合价的变化,均为氧化还原反应,a项正确;
b.总反应为2H2O![]() 2H2+O2,循环过程中产生1molH2,同时产生0.5molO2;b项错误;
2H2+O2,循环过程中产生1molH2,同时产生0.5molO2;b项错误;
c.将Ⅰ+Ⅱ+Ⅲ×![]() 可得H2O
可得H2O![]() H2+
H2+![]() O2,在整个分解水的过程中SO2和I2相当于催化剂,c项正确;
O2,在整个分解水的过程中SO2和I2相当于催化剂,c项正确;
故答案为:b。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案