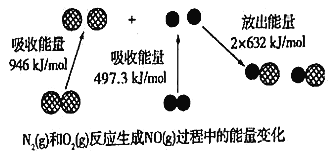
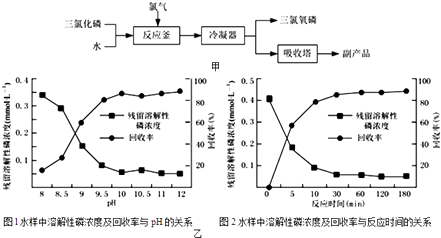
��Ŀ����
����Ŀ��Ϊ���о�MnO2��˫��ˮ��H2O2���ķ�Ӧ���ʣ�ijѧ������������MnO2��ĩ��50mL�ܶ�Ϊ1.1g/cm3��˫��ˮ��Һ�У�ͨ��ʵ��ⶨ���ڱ�״���·ų�����������ʱ��Ĺ�ϵ��ͼ��ʾ������ͼ�ش��������⣺ 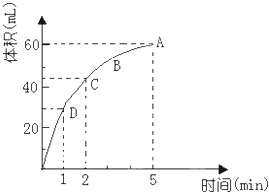
��1���ų�һ����������Ҫ��ʱ��Ϊ��
��2��A��B��C��D���㷴Ӧ���ʿ�����˳���� ��
��3����5min���ռ�������������������ӣ�ԭ���� ��
��4������������Һ�ij�ʼ���ʵ���Ũ��Ϊ ��
���𰸡�
��1��1min
��2��D��C��B��A
��3����ʱ˫��ˮ����ȫ�ֽ�
��4��0.11 mol?L��1
���������⣺��1����ͼ���֪�����ų�һ����������Ҫ��ʱ��Ϊ1min�����Դ��ǣ�1 min�� ��2����Ӧ��Ũ�ȴ�С������Ӧ���ʴ�С�����ŷ�Ӧ�Ľ��У�˫��ˮ��Ũ����С����Ӧ����Ҳ���ż�С�����Դ��ǣ�D��C��B��A�� ��3���÷�ӦΪ�����淴Ӧ����5min���ռ�������������������ӣ�˵������������ȫ�ֽ⣬���Դ��ǣ���ʱ˫��ˮ����ȫ�ֽ⣮��4���ɷ�Ӧ����ʽΪ��2H2O2 ![]() 2H2O+O2�����÷�ӦΪ�����淴Ӧ����5min���ռ�������������������ӣ�˵������������ȫ�ֽ⣬ ��ͼ���֪���������������Ϊ60mL��
2H2O+O2�����÷�ӦΪ�����淴Ӧ����5min���ռ�������������������ӣ�˵������������ȫ�ֽ⣬ ��ͼ���֪���������������Ϊ60mL��
2H2O2 | O2�� |
2mol | 22.4L |
n��H2O2�� | 0.06L |
n��H2O2��= ![]() =0.00536mol������c��H2O2��=
=0.00536mol������c��H2O2��= ![]() =0.11 molL��1 ��
=0.11 molL��1 ��
���Դ��ǣ�0.11 molL��1 ��

 �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д� �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�����Ŀ����֪��﮻Կ���Ҫ�ɷ�ΪLiAlSi2O6 �� ������FeO��MgO��CaO�����ʣ�����������﮻Կ�Ϊԭ������ȡ����﮵�һ�ֹ������̣�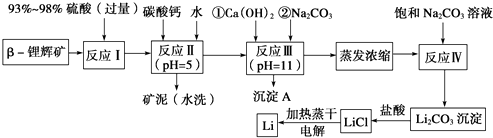
��֪���ٲ��ֽ����������↑ʼ��������ȫ����ʱ��pH��
�������� | Fe��OH��3 | Al��OH��3 | Mg��OH��2 |
��ʼ����pH | 2.7 | 3.7 | 9.6 |
��ȫ����pH | 3.7 | 4.7 | 11 |
��Li2CO3�ڲ�ͬ�¶��µ��ܽ�����±���
�¶�/�� | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3���ܽ��/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
��ش��������⣺
��1��Ϊ����ߦ�﮻Կ�����ʿɲ�ȡ��ʩ�� ��
��2����Ӧ��������Ӧ��LiAlSi2O6+H2SO4��ŨLi2SO4+++H2O������������ƽ��������ʽ��
��3����Ӧ�����̼��Ƶ������� ��
��4����Ӧ�������ɳ���A�ɷ֣� �� ���ѧʽ��
��5������Ũ����������Ҫ�������ӷ�Ӧ����ʽ�� ��
��6��ϴ������Li2CO3����Ҫʹ����ѡ���ˮ������ˮ��������ѡ��������� ��
��7����������Ȼ�������ʱ������������Cl2�л��������O2 �� �õ缫��Ӧʽ˵��ԭ�� ��