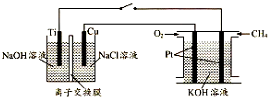
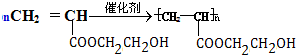题目内容
3.某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下: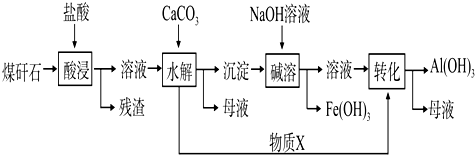
(1)“酸浸”过程中主要反应的离子方程式为Al2O3+6H+═2Al3++3H2O、Fe2O3+6H+═2Fe3++3H2O.
(2)“酸浸”时铝浸出率的影响因素可能有酸的浓度、温度.(写出两个)
(3)“碱溶”的目的是发生反应为Al(OH)3+OH-=AlO2-+2H2O,将Al(OH)3转化为AlO2-,以便和Fe(OH)3分离.物质X的化学式为CO2.
(4)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4.为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3.
(5)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3溶液中不断通入HCl气体,可析出大量AlCl3•6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:AlCl3饱和溶液中存在溶解平衡:
AlCl3•6H2O(s)?Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl气体使溶液中c(Cl-)增大,平衡向析出固体的方向移动从而析出AlCl3晶体.
分析 含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物用盐酸酸浸发生的反应为:Al2O3+6H+═2Al3++3H2O;Fe2O3+6H+═2Fe3++3H2O;则过滤的溶液为
氯化铁和氯化铝的溶液,加碳酸钙消耗溶液中的氢离子使三价铁离子、三价铝离子都水解生成氢氧化铁、氢氧化铝的沉淀,所以再加入氢氧化钠,只要氢氧化铝溶解反应为:Al(OH)3+OH-═AlO2-+2H2O,所得溶液为偏铝酸钠溶液再通入二氧化碳进一步反应又生成氢氧化铝;
(1)能和酸反应的物质有氧化铝和氧化铁,氧化铝是两性氧化物,而氧化铁是碱性氧化物,两者与酸反应生成盐和水;
(2)酸浸”时铝浸出率的影响因素可能是酸的浓度、温度、反应物的接触面积、反应时间等都影响反应速率;
(3)氢氧化铝是两性氢氧化物和氢氧化钠能反应生成偏铝酸钠;X是碳酸钙和水解中的氢离子反应生成二氧化碳;
(4)由于Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,而Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4.所以为了得到纯净的Al(OH)3,首先加入CaCO3调节pH到3.2,得到Fe(OH)3,将其过滤除去后;
(5)氯化氢抑制氯化铝溶解.
解答 解:含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物用盐酸酸浸发生的反应为:Al2O3+6H+═2Al3++3H2O;Fe2O3+6H+═2Fe3++3H2O;则过滤的溶液为氯化铁和氯化铝的溶液,加碳酸钙消耗溶液中的氢离子使三价铁离子、三价铝离子都水解生成氢氧化铁、氢氧化铝的沉淀,所以再加入氢氧化钠,只要氢氧化铝溶解反应为:Al(OH)3+OH-═AlO2-+2H2O,所得溶液为偏铝酸钠溶液再通入二氧化碳进一步反应又生成氢氧化铝;
(1)氧化铝和氧化铁都能和盐酸反应生成盐和水,反应方程式分别是:Al2O3+6H+═2Al3++3H2O、Fe2O3+6H+═2Fe3++3H2O,
故答案为:Al2O3+6H+═2Al3++3H2O;Fe2O3+6H+═2Fe3++3H2O;
(2)酸的浓度、温度、反应物接触面积、是否充分搅拌、反应时间等都影响反应速率,故答案为:酸的浓度;温度;
(3)氯化铝和氯化铁水解都生成盐酸,碳酸钙和盐酸反应生成氯化钙和二氧化碳,所以物质X是二氧化碳,氢氧化铝和氢氧化钠溶液反应生成可溶性偏铝酸钠,离子反应方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:发生反应为Al(OH)3+OH-=AlO2-+2H2O,将Al(OH)3 转化为AlO2-,以便和Fe(OH)3分离;CO2;
(4)Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4,要使铁离子完全沉淀而铝离子不沉淀,则溶液的PH应该为3.2,过滤氢氧化铝沉淀时调节溶液pH为5.4,以使氢氧化铝完全沉淀,
故答案为:加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3;
(5)氯化铝在溶液中存在溶解平衡,通入氯化氢后溶液中氯离子浓度增大,抑制氯化铝溶解,所以促进氯化铝晶体析出,故答案为:AlCl3饱和溶液中存在溶解平衡:AlCl3•6H2O(s)?Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl气体使溶液中c(Cl-)增大,平衡向析出固体的方向移动从而析出AlCl3晶体.
点评 本题以工艺流程为载体考查了溶解平衡原理、物质间的反应、除杂等知识点,这种题型是高考常考题型,综合性较强,涉及知识面较广,用教材基础知识采用知识迁移的方法分析解答,难度不大.

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案| A. | 无色溶液中可能大量存在Al3+、NH4+、Na+、Cl?、S2?、AlO2- | |
| B. | c(H+):c(OH-)=1:1012的溶液中Mg2+、Cu2+、Fe2+、SO42-、Cl?、NO3-可以大量共存 | |
| C. | pH=8的溶液中可能大量存在Na+、K+、Ba2+、Cl-、HCO3-、NO3- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Al3+、Cl-、SO42-、NO3- |
| 选项 | 现象或事实 | 分析 |
| A | 发电厂将燃煤产生的废气通入高温下的石灰石 | 主要目的是生产CaSO4并得到副产品CO2 |
| B | ClO2代替Cl2对饮用水消毒 | ClO2消毒杀毒效率高,二次污染小 |
| C | 苏打、苛性钠可用于治疗胃酸过多 | 苏打、苛性钠都与胃酸反应 |
| D | 用环保绿色融雪除冰剂代替氯化钙、氯化钠融雪除冰 | 氯化钙、氯化钠会造成环境污染,但不会加速桥梁等设备腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
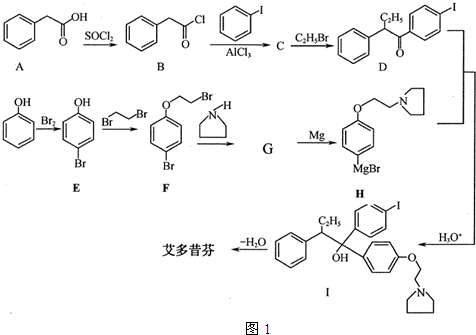
 ; 艾多昔芬
; 艾多昔芬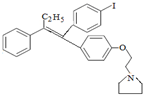 .
.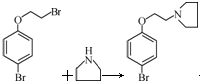 +HBr
+HBr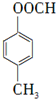 .
.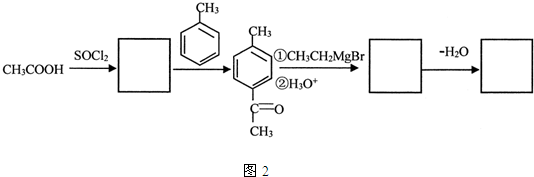
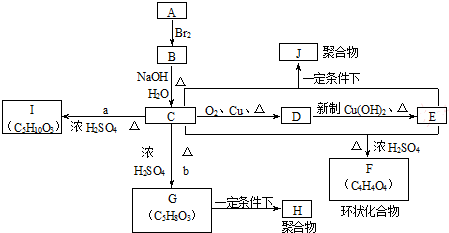
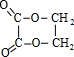 ;指出C→G的反应类型酯化(取代)反应.
;指出C→G的反应类型酯化(取代)反应.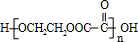 +(2n-1)H2O
+(2n-1)H2O