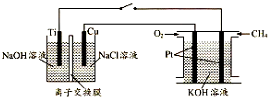
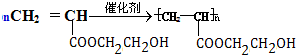题目内容
20.下列叙述不正确的是( )| A. | 同周期元素的原子半径以ⅦA族的为最小 | |
| B. | 在周期表中零族元素的单质全部是气体 | |
| C. | ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子 | |
| D. | 所有主族元素的原子形成单原子离子时的最高正价数都和它的族数相等 |
分析 A.同一周期元素,原子半径随着原子序数增大而减小(稀有气体除外);
B.在周期表中0族元素单质都是气体且是单原子分子气体;
C.同一主族元素,元素的金属性随着原子序数增大而增强,元素的金属性越强其原子越容易失去电子,原子半径随着原子序数增大而增大;
D.主族元素最高正化合价与其族序数相等,但O、F元素除外.
解答 解:A.同一周期元素,原子核外电子层数相等,随着核电荷数的增大,原子核吸引电子能力越大导致其半径减小,所以同周期元素的原子半径以ⅦA族的为最小,故A正确;
B.在周期表中0族元素单质都是气体且是单原子分子气体,故B正确;
C.同一主族元素,元素的金属性随着原子序数增大而增强,元素的金属性越强其原子越容易失去电子,原子半径随着原子序数增大而增大,所以ⅠA、ⅡA族元素的原子,其半径越大越容易失去电子,故C正确;
D.主族元素最高正化合价与其族序数相等,但O、F元素除外,F、O元素没有正化合价,故D错误;
故选D.
点评 本题考查同一主族、同一周期元素原子结构和性质递变规律,以碱金属族、卤族元素为例熟练掌握同一主族元素性质递变规律,注意规律中的反常现象,易错选项是D.

练习册系列答案
相关题目
15.化学与生产、生活关系密切,下列现象或事实及其分析都正确的是( )
| 选项 | 现象或事实 | 分析 |
| A | 发电厂将燃煤产生的废气通入高温下的石灰石 | 主要目的是生产CaSO4并得到副产品CO2 |
| B | ClO2代替Cl2对饮用水消毒 | ClO2消毒杀毒效率高,二次污染小 |
| C | 苏打、苛性钠可用于治疗胃酸过多 | 苏打、苛性钠都与胃酸反应 |
| D | 用环保绿色融雪除冰剂代替氯化钙、氯化钠融雪除冰 | 氯化钙、氯化钠会造成环境污染,但不会加速桥梁等设备腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
5.下表是元素周期表的一部分,回答下列有关问题:
(1)在上表所列出的元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(2)③和⑤最高价氧化物所对应的水化物之间可以反应,写出反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)①、⑥、⑦、⑧最高价氧化物所对应的水化物中性质明显不同的是H2SiO3.(填化学式)
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
(2)③和⑤最高价氧化物所对应的水化物之间可以反应,写出反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)①、⑥、⑦、⑧最高价氧化物所对应的水化物中性质明显不同的是H2SiO3.(填化学式)
10.下列实验设计方案中,可行的是( )
| A. | 用加入适量铜粉的方法除去Cu(NO3)2溶液中混有的AgNO3 | |
| B. | 用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液的SO42- | |
| D. | 先后添加酚酞试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
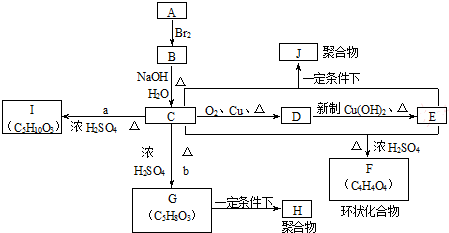
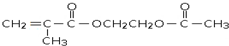 是锂电池正负极之间锂离子迁移的介质.由烃C4H8合成M的合成路线如图:
是锂电池正负极之间锂离子迁移的介质.由烃C4H8合成M的合成路线如图:
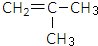 ,试剂II是NaOH水溶液.
,试剂II是NaOH水溶液.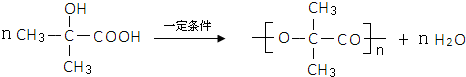 ;
;
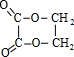 ;指出C→G的反应类型酯化(取代)反应.
;指出C→G的反应类型酯化(取代)反应.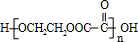 +(2n-1)H2O
+(2n-1)H2O