题目内容
5.当将浓氨水靠近氯气时,可以看到白烟(NH4Cl)生成,所以工厂里常用浓氨水来检 验氯气管道是否泄漏.在此反应中:氯气和氨气可发生如下反应 8NH3+3Cl2=6NH4Cl+N2,(1)该反应中氧化剂是Cl2,被氧化的是N元素.
(2)若产生标准状况下 N233.6L,则被氧化的还原剂的物质的量为3mol.
(3)用双线桥法标出上述反应电子转移的方向与数目.
分析 8NH3+3Cl2=N2+6NH4Cl中,Cl元素的化合价降低,N元素的化合价升高,3molCl2作氧化剂与2molNH3作还原剂转移电子相等,结合元素的化合价变化计算转移电子.
解答 解:(1)8NH3+3Cl2=N2+6NH4Cl中,Cl元素的化合价降低,Cl2作氧化剂,N元素的化合价升高,N元素被氧化;
故答案为:Cl2;N;
(2)反应中3molCl2作氧化剂与2molNH3作还原剂转移电子相等,生成1mol氮气,则产生标准状况下 N233.6L,即1.5mol氮气时被氧化的还原剂为3mol;
故答案为:3mol;
(3)化学反应3Cl2+8NH3=6NH4Cl+N2中,Cl元素化合价由0→-1价,N元素化合价由-3价→价,氧化还原反应氧化剂与还原剂得失电子数目相等,表现为化合价升降总数相等,用双线桥标出电子转移的方向和数目可为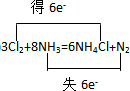 ,
,
故答案为: .
.
点评 本题考查氧化还原反应及有关计算,把握反应中元素的化合价变化及电子数计算为解答的关键,题目难度不大,侧重分析与计算能力的考查.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
16.下列说法正确的是( )
| A. | 邻二甲苯苯环上的一氯取代产物有4种 | |
| B. | 甲苯分子中最多有12个原子在同一平面内 | |
| C. | 乙二醇与甘油互为同系物 | |
| D. | 油脂在烧碱溶液中能发生水解反应 |
20.下列实验,所选装置合理的是
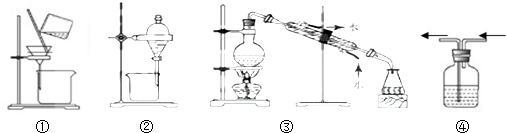 ( )
( )
 ( )
( )| A. | 提纯含NaCl的氢氧化铁胶体用装置① | |
| B. | 分离碘的四氯化碳溶液用② | |
| C. | 分离NaCl的酒精溶液用装置③ | |
| D. | 除去Cl2中的HCl气体用装置④ |
10.用铁与稀硫酸反应制取氢气时,下列不能使氢气生成速率加大的是( )
| A. | 在稀硫酸溶液中滴加少量硫酸铜溶液 | |
| B. | 不用稀硫酸,改用98%的浓硫酸 | |
| C. | 不用1 mol/L稀硫酸,改用2 mol/L硫酸 | |
| D. | 不用铁片,改用铁粉 |
17.下列反应类型错误的是( )
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ 中和反应 | |
| B. | H2+CuO $\frac{\underline{\;△\;}}{\;}$ Cu+H2O 置换反应 | |
| C. | CaCO3 $\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑ 分解反应 | |
| D. | CuO+H2SO4═CuSO4+H2O 复分解反应 |
 如图所示,a、b均为活塞,可控制气体的通过和液体的加入,实验前活塞均已关闭(仪器的固定装置已省略).请选择最适宜的试剂,利用下图,把一定量的CO2和CO混合气体中的CO2和CO分离.
如图所示,a、b均为活塞,可控制气体的通过和液体的加入,实验前活塞均已关闭(仪器的固定装置已省略).请选择最适宜的试剂,利用下图,把一定量的CO2和CO混合气体中的CO2和CO分离.