题目内容
1.影响化学反应速率的因素很多,株洲二中课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题.Ⅰ取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中.足量镁条与一定量盐酸反应生成H2 的量与反应时间的关系曲线如图2所示.
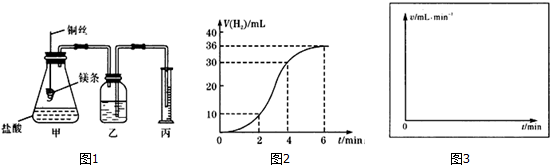
(1)请在图3的方框中画出上述反应的速率与时间的关系曲线.
(2)在前4min 内,镁条与盐酸的反应速率逐渐加快,在4min 之后,反应速率逐渐减慢,
请简述其原因:镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大;4min后由于溶液中H+浓度降低,所以导致反应速率减小.
Ⅱ小组同学发现,若改用纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快.他们决定对其原因进行探究.填写下列空白:
(3)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因①:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因②:Cl-对反应没有影响,而SO42-对反应具有阻碍作用;
原因③:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因④:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因⑤:Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大).
(4)该同学设计并进行了两组实验,即得出了正确结论.他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl 或KCl 固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4 或K2SO4 固体,观察反应速率是否变化.
若观察到实验a 中反应速率加快,实验b 中反应速率减慢,则说明原因③是正确的.依此类推.该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用.
(5)根据所学,若要加快铝片与硫酸溶液制H2 的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂; ②滴加少量CuSO4 溶液; ③将铝片剪成100 条; ④增加硫酸的浓度至18mol/L; ⑤加入蒸馏水; ⑥加入少量KNO3 溶液; ⑦升高温度其中,你认为不合理的方案有④⑤⑥.
分析 (1)先根据图2找出2、4、6min时刻时的氢气体积的变化量,再找出2、4、6min时刻时的速率与时间的关系,然后用平滑曲线描绘图象.
(2)根据该反应的反应热及溶液中氢离子的浓度判断.
(3)原因②:先确定Cl-对反应没有影响再猜测硫酸根离子的作用;
原因⑤:根据原因④提出与原因⑤相反的观点;
(4)根据a、b对比实验中的现象判断原因③;
(5)影响该化学反应速率的因素可能是温度、浓度、接触面积和催化剂等,据此分析.
解答 解:(1)2、4、6min时刻时氢气体积的分别为10 mL、20mL、36mL,其平均反应速率分别为5 mL/min、7.5mL/min、6mL/min,然后标出速率与时间图象为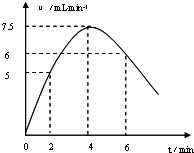 ,故答案为:
,故答案为:
(2)该反应是放热反应,随着反应的进行,放出的热量越多,溶液的温度越高,反应速率越大;随着反应的进行,溶液中氢离子的浓度逐渐减小,浓度越小,反应速率越小,
故答案为:镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大;4min后由于溶液中H+浓度降低,所以导致反应速率减小;
(3)②根据原因①结合题意,提出与原因①相反的观点,
故答案为:Cl-对反应没有影响,而SO42-对反应具有阻碍作用;
⑤根据原因④结合题意,提出与原因④相反的观点,
故答案为:Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大);
(4)a中原来时快有硫酸根离子,后加入氯离子,如果氯离子有促进作用,那么反应速率就比未加时快,以此证明原因③是正确的.
b中中原来时快有氯离子,后加入硫酸根离子,如果硫酸根离子有阻碍作用,那么反应速率比未加时慢,以此说明因Ⅲ是正确的.
故答案为:反应速率加快; 反应速率减慢.
(5)①加入某种催化剂,可以加快反应速率,故①正确;
②加入硫酸铜溶液,Al能够置换出铜,形成铝铜原电池,加快反应速率,故②正确;
③将铝片剪成100 条,增大了反应物的接触面积,反应速率加快,故③正确;
④硫酸的浓度至18mol/L时,Al在其中会钝化,故④错误;
⑤加入蒸馏水,降低氢离子浓度,反应速率减慢,故⑤错误;
⑥加入少量KNO3 溶液,溶液中氢离子与硝酸根离子和Al反应生成NO,不生成氢气,故⑥错误;
⑦升高温度,反应速率加快,故⑦正确;
故答案为:④⑤⑥.
点评 本题考查应向化学反应速率的实验探究,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握实验原理,为解答该题的关键.

| A. | 中和反应是吸热反应 | |
| B. | 燃烧属于放热反应 | |
| C. | 断裂化学键要放出能量 | |
| D. | 反应物总能量一定等于生成物总能量 |
| A. | 0 | B. | 175 | C. | 57 | D. | 118 |
| A. | Na2S溶液使酚酞试液变红:S2-+2H2O?2OH-+H2S | |
| B. | 用右图装置电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+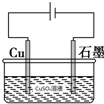 | |
| C. | NaHCO3溶液使酚酞试液变红:HCO3-+H2O?H3O++CO32- | |
| D. | 用AlCl3溶液使石蕊试液变红:Al3++3H2O?Al(OH)3+3 H+ |
| A. | 同主族元素形成的单质熔沸点自上而下逐渐升高 | |
| B. | 核外电子排布相同的微粒化学性质不一定相同 | |
| C. | 第三周期中,除稀有气体元素外原子半径最大的是氯 | |
| D. | 同主族元素氢化物的稳定性越强其沸点就越高 |
| A. | 原子半径:Li>Na | B. | 最外层电子数都相同 | ||
| C. | 核外电子层数相同 | D. | 核外电子数相同 |
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:Ba(OH)2>Mg(OH)2>Be(OH)2 | ||
| C. | 非金属性:F>C>O | D. | 气态氢化物稳定性:HF>HCl>H2S |
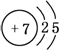
 H2SO3、2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4.
H2SO3、2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4.