题目内容
4.实验室用铜和浓硫酸反应制取二氧化硫,下列有关该反应的说法错误的是( )| A. | 铜是还原剂,发生了氧化反应 | |
| B. | 每生成64 g SO2,转移电子的物质的量是2 mol | |
| C. | 每消耗1 mol Cu,起氧化剂作用的硫酸消耗2 mol | |
| D. | 在此反应中,浓硫酸表现出酸性和氧化性 |
分析 发生Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O,利用化合价的变化分析氧化剂、还原剂、消耗的酸及转移的电子数,以此来解答.
解答 解:A.反应中Cu元素的化合价由0升高到+2价,作还原剂,发生氧化反应,故A正确;
B.由Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O可知,每生成1molSO2,即64 g SO2,转移电子的物质的量为1mol×(6-4)=2mol,故B正确;
C.由Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O可知,每消耗1molCu,起氧化剂作用的硫酸消耗1mol,故C错误;
D.该反应有硫酸铜生成,体现酸性,生成二氧化硫体现其氧化性,故D正确;
故选C.
点评 本题考查铜与浓硫酸的反应及氧化还原反应计算,为高频考点,把握发生的化学反应及利用化合价分析氧化还原反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
14.下列有关化学用语表示正确的是( )
| A. | -CHO的电子式: | B. | 丙烷分子的比例模型为: | ||
| C. | 顺-1,2-二溴乙烯结构式为: | D. | 1,4-二甲苯的结构简式为: |
15.在含有FeBr2和FeI2的混合溶液中,通入过量的氯气,然后把溶液加热蒸干、灼烧,最后留下的是( )
①FeCl2②FeCl3③I2④Br2⑤Fe(OH)3⑥Fe2O3⑦FeO.
①FeCl2②FeCl3③I2④Br2⑤Fe(OH)3⑥Fe2O3⑦FeO.
| A. | ①③④ | B. | ③⑦ | C. | ③⑤ | D. | ⑥ |
12.关于化学反应与能量的说法正确的是( )
| A. | 中和反应是吸热反应 | |
| B. | 燃烧属于放热反应 | |
| C. | 断裂化学键要放出能量 | |
| D. | 反应物总能量一定等于生成物总能量 |
16.超铀元素的发现有力地支持了“稳定岛”假说,原子${\;}_{118}^{293}$X的中子数与电子数之差为( )
| A. | 0 | B. | 175 | C. | 57 | D. | 118 |
13.下列有关元素的性质及其递变规律叙述正确的是( )
| A. | 同主族元素形成的单质熔沸点自上而下逐渐升高 | |
| B. | 核外电子排布相同的微粒化学性质不一定相同 | |
| C. | 第三周期中,除稀有气体元素外原子半径最大的是氯 | |
| D. | 同主族元素氢化物的稳定性越强其沸点就越高 |
14.下列各反应中,可以证明烯烃具有不饱和结构的是( )
| A. | 燃烧反应 | B. | 加聚反应 | C. | 消去反应 | D. | 取代反应 |
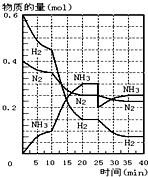 (1)在一定条件下,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图:
(1)在一定条件下,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图:
 H2SO3、2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4.
H2SO3、2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4.