题目内容
3.在密闭容器中加入NaHCO3和NaOH的混合物共36.8g,加热至250℃,经充分反应后排出气体,冷却得到剩余固体质量为33.2g,试计算原固体混合物中两种组分的质量(写出必要的计算过程).分析 加热过程中可能发生的反应为NaHCO3+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O①、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑②,加热冷却后,固体减少的质量=36.8g-33.2g=3.6g,
如果NaHCO3和NaOH恰好反应或NaOH过量,则发生①的反应,如果NaHCO3过量,发生①②的反应,
如果恰好反应,设生成水的质量为x
NaHCO3+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O
124g 18g
36.8g x
124g:18g=36.8g:x
x=$\frac{18g×36.8g}{124g}$=5.34g>3.6g,则NaOH过量,
再结合方程式计算.
解答 解:加热过程中可能发生的反应为NaHCO3+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O①、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑②,加热冷却后,固体减少的质量=36.8g-33.2g=3.6g,
如果NaHCO3和NaOH恰好反应或NaOH过量,则发生①的反应,如果NaHCO3过量,发生①②的反应,
如果恰好反应,设生成水的质量为x
NaHCO3+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O
124g 18g
36.8g x
124g:18g=36.8g:x
x=$\frac{18g×36.8g}{124g}$=5.34g>3.6g,则NaOH过量,
只发生反应NaHCO3+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O
设碳酸氢钠质量为y,
NaHCO3+NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O
84g 18g
y 3.6g
84g:18g=y:3.6g
y=$\frac{84g×3.6g}{18g}$=16.8g
所以氢氧化钠质量=36.8g-16.8g=20g,
答:原固体中碳酸氢钠、氢氧化钠质量分别是16.8g、20g.
点评 本题考查混合物的有关计算,侧重考查学生分析计算能力,正确判断哪种物质过量及发生的反应是解本题关键,注意方程式①的灵活运用,题目难度中等.

| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1mol石墨比1mol金刚石的总能量高 | |
| D. | 1mol石墨和1mol金刚石的总能量相等 |
| A. | 5.6g铁粉在0.1 mol氯气中充分燃烧,失去的电子数为0.3NA | |
| B. | 标准状况下,2.24 L CHCl3的分子数为0.1NA | |
| C. | 1L0.1mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA | |
| D. | 9.2gNO2和N2O4的混合气体中含有的氮原子数为0.2NA |
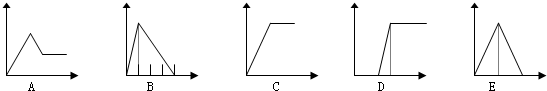
| 溶液 | 加入的物质 | 答案序号 |
| (1)饱和石灰水 | 通CO2至过量 | E |
| (2)AlCl3溶液 | 通过量的NH3 | C |
| (3)含少量HCl的AlCl3溶液 | 通过量的NH3 | D |
| (4)NaAlO2溶液 | 滴加稀HCl至过量 | B |
| (5)MgCl2 和AlCl3的混和液 | 滴加NaOH至过量 | A |
| A. | FeBr2溶液中通入少量Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | 金属钠跟水反应2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 碳酸钡溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
| A. | (A-x+n)mol | B. | (A-x-n)mol | C. | (A-x+n)n/Amol | D. | (A-x-n)n/Amol |
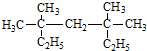 3,3,5,5-四甲基庚烷;
3,3,5,5-四甲基庚烷; 已知反应:2NO2(g)?N2O4(g),△H<0,为了探究温度对化学平衡的影响,有人做了如图实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500mL 6mol/L的HCl溶液和盛有500mL蒸馏水的烧杯中(两烧杯中溶液的温度相同).
已知反应:2NO2(g)?N2O4(g),△H<0,为了探究温度对化学平衡的影响,有人做了如图实验:把NO2和N2O4的混合气体通入甲、乙两个连通的烧瓶里,然后用夹子夹住橡皮管,把两烧瓶分别浸入两个分别盛有500mL 6mol/L的HCl溶液和盛有500mL蒸馏水的烧杯中(两烧杯中溶液的温度相同).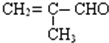 ,请推测其具有的化学性质,填写下列空白:
,请推测其具有的化学性质,填写下列空白: