题目内容
20.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种.已知:①a、c皆能与稀硫酸反应放出气体;
②b与d的硝酸盐反应,置换出单质d;
③c与强碱反应放出气体;
④c、e在冷浓硫酸中发生钝化.由此可判断a、b、c、d、e依次为( )
| A. | Fe Cu Al Ag Mg | B. | Al Cu Mg Ag Fe | ||
| C. | Mg Cu Al Ag Fe | D. | Mg Ag Al Cu Fe |
分析 ①a、c皆能与稀硫酸反应放出气体,说明在金属活动性顺序表中,a、c位于H元素之前;
②b与d的硝酸盐反应,置换出单质d,说明活动性b>d;
③c与强碱反应放出气体,中学阶段学习的只有Al能和强碱溶液生成氢气,所以为Al;
④c、e在冷浓硫酸中发生钝化,为Al、Fe,
据此判断金属物质.
解答 解:③与强碱反应放出气体,中学阶段学习的只有Al能和强碱溶液生成氢气,所以为Al;
④c、e在冷浓硫酸中发生钝化,为Al、Fe,则e是Fe;
①a、c皆能与稀硫酸反应放出气体,说明在金属活动性顺序表中,a、c位于H元素之前,则a是Mg;
②b与d的硝酸盐反应,置换出单质d,说明活动性b>d,则b是Cu、d是Ag;
通过以上分析知,断a、b、c、d、e依次为Mg、Cu、Al、Ag、Fe,故选C.
点评 本题考查金属活动性强弱顺序判断,为高频考点,明确金属活动性顺序表及金属性质即可解答,题目难度不大.

练习册系列答案
相关题目
10.将0.4mol金属Al全部转化为Al(OH)3,消耗a mol HCl、b mol NaOH,则a+b的最小值为( )
| A. | 1.6 | B. | 0.8 | C. | 0.6 | D. | 0.4 |
11.下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
| A. | 实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸 | |
| B. | 用MgCl2•6H2O制取无水MgCl2时需在HCl气流中进行 | |
| C. | 饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 | |
| D. | 合成氨工业中使用铁触媒做催化剂 |
15.在①丙烯②氯乙烯③苯④甲苯四种有机化合物中,分子内所有原子均在同一平面的是( )
| A. | ②③ | B. | ②④ | C. | ①③ | D. | ③④ |
5.下列有机化合物分子中含有手性碳原子,且与H2发生加成反应后仍含有手性碳原子的是( )
| A. | CH3CH2CHO | B. | OHCCH(OH)CH2OH | ||
| C. | 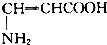 | D. | 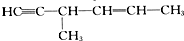 |
12.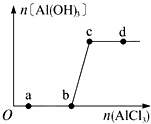 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成Al (OH)3沉淀的量随ALCL3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成Al (OH)3沉淀的量随ALCL3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
 向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成Al (OH)3沉淀的量随ALCL3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成Al (OH)3沉淀的量随ALCL3加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液中:Na+、Fe3+、SO4-、HCO3- | |
| B. | b点对应的溶液中:Na+、S2-、SO42-、Cl- | |
| C. | c点对应的溶液中:Ag+、Ca2+、NO3-、F- | |
| D. | d点对应的溶液中:K+、NH4+、CO32-、I- |
9.通过加入过量的化学试剂,采用恰当的方法分离提纯混合物,除去某溶液里溶解的杂质(括号内的物质为杂质),下列做法中正确的是( )
| A. | NaCl溶液(BaCl2):加Na2SO4溶液,过滤 | |
| B. | NaCl溶液(I2):加酒精,萃取 | |
| C. | KNO3溶液(AgNO3):加NaCl溶液,过滤 | |
| D. | KNO3溶液(I2):加CCl4,萃取 |
10.下列实验设计科学合理的是( )
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| C. | 用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- | |
| D. | 用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,可知原溶液中有Na+无K+ |

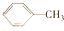 $\stackrel{KMnO_{4}(H)}{→}$
$\stackrel{KMnO_{4}(H)}{→}$
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$  (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化) .
. .
. .
.