题目内容
19.温度为t℃时,在体积为10L的真空容器中通入1.00mol氢气和1.00mol碘蒸气,20min后,反应达到平衡,此时测得碘蒸气的浓度为0.020mol•L-1.涉及的反应可以用下面的两个化学方程式表示:①H2(g)+I2(g)?2HI(g)
②2H2(g)+2I2(g)?4HI(g)
下列说法正确的是( )
| A. | 反应速率用HI表示时,v(HI)=0.008 mol•L-1•min-1 | |
| B. | 两个化学方程式的意义相同,但其平衡常数表达式不同,不过计算所得数值相同 | |
| C. | 氢气在两个反应方程式中的转化率不同 | |
| D. | 第二个反应中,增大压强平衡向生成HI的方向移动 |
分析 A、v=$\frac{△c}{△t}$进行计算求解;
B、因为平衡常数的表达式不同,所以计算所得数值不相同;
C、两个化学方程式的意义相同,氢气在两个反应方程式中的转化率相同;
D、两边气体计量数相等,所以增大压强,平衡不移动.
解答 解:A、起始时1.00mol碘蒸气,20min后,反应达到平衡,此时测得碘蒸气的浓度为0.020mol•L-1,所以浓度变化量为:0.08mol•L-1所以的浓度变化量为0.16mol•L-1,v=$\frac{△c}{△t}$=$\frac{0.16}{20}$=0.008 mol•L-1•min-1,故A正确;
B、因为平衡常数的表达式不同,所以计算所得数值不相同,故B错误;
C、两个化学方程式的意义相同,氢气在两个反应方程式中的转化率相同,而不是不同,故C错误;
D、两边气体计量数相等,所以增大压强,平衡不移动,故D错误;
故选A.
点评 本题考查化学反应速率、化学平衡常数表达式、转化率和平衡的移动,难度不大,注意基础知识的积累.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
10.下列叙述正确的是( )
| A. | 钠在空气中燃烧生成Na2O | |
| B. | 热稳定性,Na2CO3比NaHCO3强,而水溶性,NaHCO3 比Na2CO3易溶于水 | |
| C. | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明该溶液一定存在Na+,不存在K+ | |
| D. | 将Na投入NH4Cl溶液中可生成两种气体 |
4.装置(Ⅰ)为铁镍(Fe-Ni)可充电电池:Fe+NiO2$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2;装置(Ⅱ)为电解示意图,当闭合开关K时,Y附近溶液先变红.下列说法正确的是( )
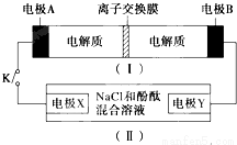

| A. | 闭合K时,X的电极反应式为:2H++2e-═H2↑ | |
| B. | 闭合K时,A电极反应式为:NiO2+2e-+2H+═Ni(OH)2 | |
| C. | 给装置(Ⅰ)充电时,B极参与反应的物质被氧化 | |
| D. | 给装置(Ⅰ)充电时,OH-通过阴离子交换膜,移向A电极 |
9.某有机物在氧气里充分燃烧,生成CO2和H2O的质量比为22:9,由此可得出的正确的结论是( )
| A. | 碳、氢、氧的原子个数比为1:2:3 | |
| B. | 碳、氢的原子个数比为1:2 | |
| C. | 该有机物中肯定不含氧元素 | |
| D. | 不能判断该有机物中是否含有氧元素 |
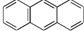 与苯炔
与苯炔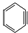 反应生成化合物X(立体对称图形),如图所示:
反应生成化合物X(立体对称图形),如图所示: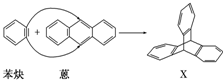
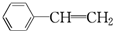 B.
B.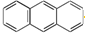 C.
C.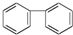 D.
D.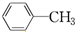
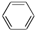 B.C6H14 C.
B.C6H14 C.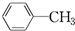 D.
D.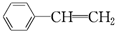
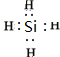 .
.