题目内容
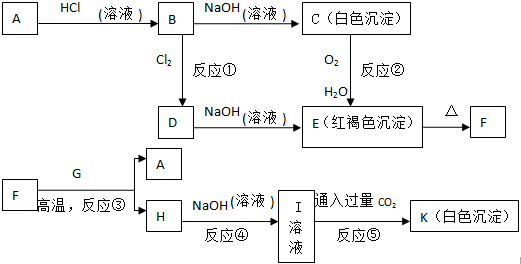
7.已知:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4(1)当反应中转移42mole?时,有7molFeS2被还原;
(2)1molFeS2可以还原7molFeS2.
(3)当有14molCuSO4参加反应时,有3.5molFeS2发生还原反应,被CuSO4氧化的FeS2有1mol.
分析 14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,Cu元素的化合价由+2价降低为+1价,S元素的化合价由-1价降低为-2价,S元素的化合价由-1价升高为+6价,以此来解答.
解答 解:(1)由方程式可知,只有S元素化合价升高,当有5molFeS2参加反应时,有3molS元素的化合价升高生成SO42-,7molS元素化合价降低,被还原,转移有3mol×[6-(-1)]=21mol e-转移,当有10molFeS2参加反应时,14molS元素化合价降低,即7molFeS2被还原,
故答案为:7;
(2)FeS2参加反应时,S元素的化合价由-1价降低为-2价,S元素的化合价由-1价升高为+6价,由得失电子数目相等可知被还原与被氧化的物质的量之比为7:1,即1molFeS2可以还原7molFeS2,
故答案为:7;
(3)由方程式可知当有14molCuSO4参加反应时,7molS元素化合价降低,被还原,则有 3.5molFeS2发生还原反应,Cu元素的化合价由+2价降低为+1价,Cu得到14mol电子,则被CuSO4氧化的FeS2有1mol,故答案为:3.5; 1.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,注意5 mol FeS2发生反应时只有3molS失去电子,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.燃煤是造成大气污染的主要原因,利用下列反应可降低污染并回收硫:SO2(g)+2CO(g)?2CO2(g)+S(l)△H<0,下列有关该反应的判断不正确的是( )
| A. | 选择不同催化剂,可以改变反应速率,不改变△H | |
| B. | 及时分离液态硫,能提高SO2的转化率 | |
| C. | 在恒容恒温容器中反应,气体压强不变时达到平衡状态 | |
| D. | 升高温度,正、逆反应速率均增大,n(CO)增大 |
18.NaHS是一种重要的化工原料,下列有关NaHS的离子反应方程式书写正确的是( )
| A. | NaHS在水中的电离方程式为NaHS═Na++H++S2- | |
| B. | NaHS溶液水解的离子方程式为HS-+H2O═H2S↑+OH- | |
| C. | NaHS溶液与FeSO4溶液反应的离子方程式为S2-+Fe2+═FeS↓ | |
| D. | 向NaHS溶液中滴加过量的新制氯水:HS-+Cl2═S↓+H++2Cl- |
12.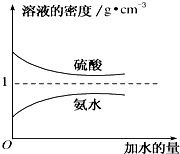 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
(1)配制480mL 1mol•L-1的硫酸溶液用到的基本实验仪器除玻璃棒、烧杯外,还有500mL容量瓶、胶头滴管、量筒.
(2)质量分数为w1的硫酸与水等体积混合,所得溶液的质量分数大于 $\frac{{w}_{1}}{2}$(填“大于”“小于”或“等于”,下同).
(3)物质的量浓度为c2 mol•L-1的氨水与$\frac{1}{5}$c2 mol•L-1的氨水等质量混合,所得溶液的密度大于ρ2 g•cm-3,所得溶液的物质的量浓度大于$\frac{3}{5}$c2 mol•L-1(混合后溶液的体积变化忽略不计).
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL 1mol/L的硫酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40mL 1mol/L的NaOH溶液.蒸发中和后的溶液,最终得到多少g固体?
 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:| 溶质的物质的量浓度/mol•L-1 | 溶液的密度/g•cm-3 | |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
(2)质量分数为w1的硫酸与水等体积混合,所得溶液的质量分数大于 $\frac{{w}_{1}}{2}$(填“大于”“小于”或“等于”,下同).
(3)物质的量浓度为c2 mol•L-1的氨水与$\frac{1}{5}$c2 mol•L-1的氨水等质量混合,所得溶液的密度大于ρ2 g•cm-3,所得溶液的物质的量浓度大于$\frac{3}{5}$c2 mol•L-1(混合后溶液的体积变化忽略不计).
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL 1mol/L的硫酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40mL 1mol/L的NaOH溶液.蒸发中和后的溶液,最终得到多少g固体?
19.温度为t℃时,在体积为10L的真空容器中通入1.00mol氢气和1.00mol碘蒸气,20min后,反应达到平衡,此时测得碘蒸气的浓度为0.020mol•L-1.涉及的反应可以用下面的两个化学方程式表示:
①H2(g)+I2(g)?2HI(g)
②2H2(g)+2I2(g)?4HI(g)
下列说法正确的是( )
①H2(g)+I2(g)?2HI(g)
②2H2(g)+2I2(g)?4HI(g)
下列说法正确的是( )
| A. | 反应速率用HI表示时,v(HI)=0.008 mol•L-1•min-1 | |
| B. | 两个化学方程式的意义相同,但其平衡常数表达式不同,不过计算所得数值相同 | |
| C. | 氢气在两个反应方程式中的转化率不同 | |
| D. | 第二个反应中,增大压强平衡向生成HI的方向移动 |
16. 三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(如图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(如图2),若原料完全反应生成三氯异氰尿酸.则氰尿酸和次氯酸的物质的量之比应为( )
三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(如图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(如图2),若原料完全反应生成三氯异氰尿酸.则氰尿酸和次氯酸的物质的量之比应为( )
 三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(如图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(如图2),若原料完全反应生成三氯异氰尿酸.则氰尿酸和次氯酸的物质的量之比应为( )
三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(如图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(如图2),若原料完全反应生成三氯异氰尿酸.则氰尿酸和次氯酸的物质的量之比应为( )| A. | 1:1 | B. | 2:3 | C. | 1:2 | D. | 1:3 |
17.NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L 二氯甲烷的分子数约为NA 个 | |
| B. | 常温常压下,2.0 g 重水(D2O)中含NA 个中子 | |
| C. | 1 L 0.1mol•L-1 的NaHCO3 溶液中HCO3-和CO32-的离子数之和为0.1NA | |
| D. | 电解精炼铜时,若阴极得到的电子数为2 NA 个,则阳极质量减少64 g |