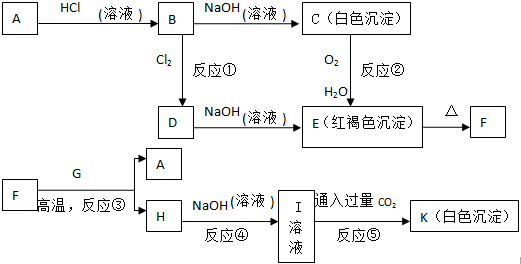
题目内容
10.下列叙述正确的是( )| A. | 钠在空气中燃烧生成Na2O | |
| B. | 热稳定性,Na2CO3比NaHCO3强,而水溶性,NaHCO3 比Na2CO3易溶于水 | |
| C. | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明该溶液一定存在Na+,不存在K+ | |
| D. | 将Na投入NH4Cl溶液中可生成两种气体 |
分析 A、钠在氧气中燃烧生成淡黄色的固体过氧化钠;
B、热稳定性,Na2CO3比NaHCO3强,而水溶性,Na2CO3 比NaHCO3易溶于水;
C、观察K的焰色应透过蓝色的钴玻璃;
D、钠和水反应生成氢氧化钠,氢氧化钠和氯化铵反应生成氨气.
解答 解;A、钠在氧气中燃烧生成淡黄色的固体过氧化钠,而不是氧化钠,故A错误;
B、热稳定性,Na2CO3比NaHCO3强,而水溶性,Na2CO3 比NaHCO3易溶于水,故B错误;
C、用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明该溶液一定存在Na+,不能确定是否存在K+,故C错误;
D、钠和水反应生成氢氧化钠,氢氧化钠和氯化铵反应生成氨气,所以将Na投入NH4Cl溶液中可生成两种气体,氢气和氨气,故D正确;
故选D.
点评 本题考查了钠元素化合物的性质,难度不大,明确“钠和水反应生成氢氧化钠,氢氧化钠和氯化铵反应生成氨气”即可解答本题.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
16.某有机物和过量的钠反应制得V1L气体,另一份等质量的该有机物和足量的碳酸氢钠反应制得V2气体(同温同压下测定),若V1=V2≠0,则该有机物可能是( )
| A. | HOCH2CH2COOH | B. | CH3COOH | C. | HOOC-COOH | D. | 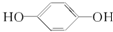 |
1.某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:
a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
(4)应用与拓展
①在足量的稀氯化亚铁溶液中加入l~2滴溴水,溶液呈黄色,所发生的离子反应方程式为2Fe2++Br2═2Fe3++2Br-.
②在FeBr2溶液中通入足量 Cl2,所发生的离子反应方程式为4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-.
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:
a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | b | 下层(CCl4层)无色 |
| 方案2 | d | 溶液变为血红色 |
①在足量的稀氯化亚铁溶液中加入l~2滴溴水,溶液呈黄色,所发生的离子反应方程式为2Fe2++Br2═2Fe3++2Br-.
②在FeBr2溶液中通入足量 Cl2,所发生的离子反应方程式为4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-.
18.NaHS是一种重要的化工原料,下列有关NaHS的离子反应方程式书写正确的是( )
| A. | NaHS在水中的电离方程式为NaHS═Na++H++S2- | |
| B. | NaHS溶液水解的离子方程式为HS-+H2O═H2S↑+OH- | |
| C. | NaHS溶液与FeSO4溶液反应的离子方程式为S2-+Fe2+═FeS↓ | |
| D. | 向NaHS溶液中滴加过量的新制氯水:HS-+Cl2═S↓+H++2Cl- |
5.下列溶液中,Na+浓度最大的是( )
| A. | 1mol/L Na2SO4溶液200mL | B. | 0.9mol/L Na3PO4溶液200mL | ||
| C. | 2.5mol/L NaOH 溶液100mL | D. | 1mol/L NaHCO3溶液300mL |
19.温度为t℃时,在体积为10L的真空容器中通入1.00mol氢气和1.00mol碘蒸气,20min后,反应达到平衡,此时测得碘蒸气的浓度为0.020mol•L-1.涉及的反应可以用下面的两个化学方程式表示:
①H2(g)+I2(g)?2HI(g)
②2H2(g)+2I2(g)?4HI(g)
下列说法正确的是( )
①H2(g)+I2(g)?2HI(g)
②2H2(g)+2I2(g)?4HI(g)
下列说法正确的是( )
| A. | 反应速率用HI表示时,v(HI)=0.008 mol•L-1•min-1 | |
| B. | 两个化学方程式的意义相同,但其平衡常数表达式不同,不过计算所得数值相同 | |
| C. | 氢气在两个反应方程式中的转化率不同 | |
| D. | 第二个反应中,增大压强平衡向生成HI的方向移动 |
20.下列叙述正确的是( )
| A. | 盛放浓硫酸的试剂瓶的标签上应印有警示标记 | |
| B. | 锥形瓶不可作为加热用的反应器 | |
| C. | 实验室制取二氧化氮时,用水或NaOH溶液吸收尾气 | |
| D. | 不慎将浓碱液沾到皮肤上,要立即涂上稀硫酸,再用大量水冲洗 |