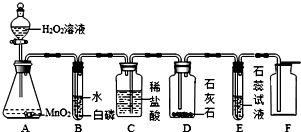
题目内容
10.工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0.图1表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
(1)下列说法正确的是AC
A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1mol CO和2mol H2,再次达到平衡时$\frac{n(C{H}_{3}OH)}{n(CO)}$会减小
(2)从反应开始到建成平衡,v(H2)=0.15mol•L-1•min-1;已知:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数,那么在该温度下CO(g)+2H2(g)?CH3OH(g)的化学平衡常数为12.若保持其它条件不变,将反应体系升温,则该反应化学平衡常数减小(填“增大”、“减小”或“不变”).
(3)请在图2中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2).
分析 (1)A.由图2利用转化的CO和平衡时CO的量来分析;
B.增加CO浓度,会促进氢气的转化,但本身的转化率降低;
C.该反应为反应前后压强不等的反应;
D.再充入1molCO和2molH2,体积不变,则压强增大,平衡正向移动;
(2)由图2计算用CO表示的反应速率,再利用反应速率之比等于化学计量数之比来计算氢气的反应速率,利用各物质平衡的浓度来计算化学平衡常数;根据温度升高,平衡逆向移动,反应物的浓度增大,生成物的浓度减少,平衡常数减小;
(3)根据温度和压强对该反应的影响来分析.
解答 解:(1)A.由图2可知生成0.75mol/LCH3OH,则反应了0.75mol/LCO,平衡时有0.25mol/LCO,即CO的起始物质的量为(0.75mol/l+0.25mol/L)×2L=2mol,故A正确;
B.增加CO浓度,会促进氢气的转化,氢气的转化率增大,但CO的转化率减小,故B错误;
C.该反应为反应前后压强不等的反应,则压强不变时,该反应达到平衡状态,故C正确;
D.再充入1molCO和2molH2,体积不变,则压强增大,平衡正向移动,再次达到平衡时n(CH3OH)/n(CO)会增大,故D错误;
故选:AC;
(2)由图2可知,反应中减小的CO的浓度为1mol/L-0.25mol/L=0.75mol/L,10min时达到平衡,
则用CO表示的化学反应速率为$\frac{0.75mol/L}{10min}$=0.075mol•L-1•min-1,
因反应速率之比等于化学计量数之比,则v(H2)=0.075mol•L-1•min-1×2=0.15mol•L-1•min-1;
CO(g)+2H2(g)?CH3OH(g)
开始(mol/L) 1 2 0
转化(mol/L) 0.75 1.5 0.75
平衡(mol/L) 0.25 0.5 0.75
则化学平衡常数为:K=$\frac{0.75}{0.25×(0.5)^{2}}$=12,
因温度升高,平衡逆向移动,反应物的浓度增大,生成物的浓度减少,平衡常数减小,
故答案为:0.15mol•L-1•min-1;12; 减小;
(3)根据反应CO(g)+2H2(g)?CH3OH(g)△H<0可知,温度越高,逆向反应进行的程度越大,甲醇的含量就越低,
压强增大,反应正向进行的程度大,则甲醇的含量高,据此画出的图象为 ,
,
故答案为: .
.
点评 本题考查物质的量浓度随时间变化的曲线,题目难度中等,正确分析图象得出合理信息是解答本题的关键,注意熟练掌握化学平衡及其影响因素,试题侧重考查学生的分析能力及灵活应用能力.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 长期饮用蒸馏水对身体有益 | B. | 电解水时,正极产生的气体是氢气 | ||
| C. | 利用蒸馏方法可以淡化海水 | D. | 水直接由氢原子和氧原子构成 |
| A. | 原子晶体中,共价键的键能越大,熔沸点越高 | |
| B. | 分子晶体中,分子间的作用力越大,该分子越稳定 | |
| C. | 分子晶体中,共价键的键能越大,熔沸点越高 | |
| D. | 原子晶体中,构成晶体的微粒一定是相同的原子 |
| A. | 在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu 2+、Fe3+、H+ | |
| B. | 在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32- | |
| C. | 在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32- | |
| D. | 在含Fe 3+、H+、NH4+ 的溶液中逐渐加入烧碱溶液:Fe3+、NH4+、H+ |
 .
.