题目内容
1.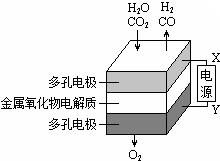 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | X是电源的负极 | |
| B. | 阴极的反应式是:H2O+2eˉ═H2+O2ˉ CO2+2eˉ=═CO+O2ˉ | |
| C. | 总反应可表示为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |
分析 A.电解池阳极发生氧化反应,阴极发生还原反应,根据与X极相连的电极产生的气体判断;
B.电解池阴极发生还原反应,根据反应物结合化合价的变化分析;
C.根据图示以及电解的目的解答;
D.根据图示知:阴极产生H2、CO,阳极产生氧气,结合C总的反应分析.
解答 解:A.根据图示知:与X相连的电极产生CO,电解H2O-CO2混合气体,二氧化碳得到电子生成一氧化碳,发生还原反应,电解池阴极发生还原反应,所以X是电源的负极,故A正确;
B.电解池阴极发生还原反应,电解H2O-CO2混合气体制备H2和CO,阴极:水中的氢原子得到电子生成氢气,H2O+2e-═H2↑+O2-,二氧化碳得到电子生成一氧化碳,CO2+2e-═CO+O2-,故B正确;
C.电解H2O-CO2混合气体制备H2和CO,根据图示知:阴极产生H2、CO,阳极产生氧气,所以总反应为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2,故C正确;
D.电解H2O-CO2混合气体制备H2和CO,总反应为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2,阴极产生H2、CO,阳极产生氧气,阴、阳两极生成的气体的物质的量之比是2:1,故D错误;
故选D.
点评 本题考查电解知识,为高频考点,侧重于考查学生的综合运用能力,题目难度中等,注意基础知识的积累掌握,掌握电解池阳极发生氧化反应,阴极发生还原反应为解答关键.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
11.下列有机反应中,不属于取代反应的是( )
| A. |  +Cl2$\stackrel{光照}{→}$ +Cl2$\stackrel{光照}{→}$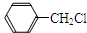 +HCl +HCl | |
| B. | CH3CH2CH2OH+CuO$\stackrel{△}{→}$CH3CH2CHO+H2O+Cu | |
| C. | CH2=CHCH2Cl+NaOH$→_{△}^{H_{2}O}$CH2=CHCH2OH+NaCl | |
| D. | 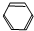 +HO-NO2$→_{50-60℃}^{浓H_{2}SO_{4}}$ +HO-NO2$→_{50-60℃}^{浓H_{2}SO_{4}}$ +H2O +H2O |
12.下列分子中中心原子的杂化方式和分子的空间构型均正确的是( )
| A. | C2H2:sp2、直线形 | B. | SO42-:sp3、三角锥形 | ||
| C. | H3O+:sp3、V形 | D. | BF3:sp2、平面三角形 |
9.在Na2CO3溶液中,下列关系正确的是( )
| A. | c(OH-)=c(H2CO3)+c(HCO3-) | B. | 2c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | ||
| C. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | D. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+(OH-) |
16.对于反应2X+Y?2Z(正反应为放热反应),达到平衡,升高温度后混合气体的平均相对分子质量下降,则下列情况正确的是( )
| A. | X和Y可能都是固体 | B. | X和Y至少有一种是气体 | ||
| C. | X和Y可能都是气体 | D. | X和Y一定都是气体 |
6.下列说法错误的是( )
| A. | 氧化钙用作儿童食品的干燥剂存在安全隐患 | |
| B. | 绿色化学的核心是利用化学原理对环境污染进行治理 | |
| C. | 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 | |
| D. | 聚乙烯、聚氯乙烯、聚苯乙烯都是通过加聚反应制得的 |
13.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O下列各组实验中最先出现浑浊的是( )
| A. | 20℃5 mL 0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4溶液,5mL H2O | |
| B. | 20℃5 mL 0.2mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mLH2O | |
| C. | 30℃5mL0.1 mol•L-1的Na2S2O3溶液,10mL 0.1 mol•L-1的H2SO4 溶液,5mLH2O | |
| D. | 30℃5 mL0,2 mol•L-1的Na2S2O3溶液,5 mL 0.2 mol•L-1的H2SO4溶液,10mL H2O |
16.下列事实不能用勒沙特列原理解释的是( )
| A. | 合成氨反应:N2(g)+3H2(g)?2NH3(g);△H<0,为使氨的产率提高,理论上应采取低温高压的措施 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系增加压强使颜色变深 | |
| C. | SO2催化氧化成SO3的反应,往往需要使用催化剂 | |
| D. | 已知反应2NO2(g)?N2O4(g),红棕色气体NO2加压后颜色先变深后变浅 |