题目内容
7.现有下列基本粒子:1H、2H、3H、1H+、234U、235U、238U、40K、40Ca、Cl2、14N、14C,请回答下列问题:(1)其中含有7种元素,属于氢元素的核素有3种,互为同位素的原子分别是1H、2H、3H,234U、235U、238U.
(2)质量数相等的粒子为1H、1H+,40K、40Ca,14N、14C(可不填满,也可补充).
(3)氢的同位素1H、2H、3H与氯的同位素35Cl、37Cl相互结合为氯化氢,可得氯化氢分子的种数为6.
分析 (1)元素就是具有相同的核电荷数(即核内质子数)的一类原子的总称;核素是指具有一定数目质子和一定数目中子的一种原子;具有相同质子数,不同中子数同一元素的不同核素互为同位素;
(2)原子符号左上角的数字为质量数;
(3)根据氢原子有三种同位素和氯原子有两种同位素,它们两两结合生成氯化氢进行判断.
解答 解:(1)元素的种类由质子数决定,质子数不同,元素的种类就不同,1H、2H、3H、1H+;234U、235U、238U;40K;40Ca;Cl2;14N;14C分别属于H;U;K;Ca;Cl;N;C7种元素,氢元素的核素有3种1H、2H、3H,1H、2H、3H互为同位素,234U、235U、238U互为同位素,
故答案为:7;3;1H、2H、3H;234U、235U、238U;
(2)1H、1H+的质量数都是1,40K、40Ca的质量数都是40,14N、14C的质量数都是14,所以质量数相等的粒子为以上三组,
故答案为:1H、1H+;40K、40Ca;14N、14C;
(3)氢原子有三种同位素H、D、T,氯原子有两种同位素35Cl、37Cl,故氯化氢分子可能为:H35Cl、H37Cl、D35Cl、D37Cl、T35Cl、T37Cl,则形成的氯化氢分子的种类有6种,
故答案为:6.
点评 本题主要考查了核数的种类、元素的种类、同位素的概念以及氢原子的三种同位素和氯原子的两种同位素的组合,题目难度中等,要注意平时的积累,氢原子的三种同位素和氯原子的两种同位素的组合为该题易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列排列顺序正确的是( )
| A. | 粒子半径:Al3+>Mg2+>F- | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
15.硫和硒(Se)、磷(Te)为同主族元素,在生产、生活中有着广泛用途.
Ⅰ、SO2、CO2转化利用是净化环境,造福人类的有效途径,一种用电化学原理,将SO2、CO2转化成用途广泛的化工产品H2SO4和CH3OH,其装置如图所示:

(1)该装置的工作原理是原电池;(填“原电池”或“电解池”)
(2)若A为CO2,B为H2,C为CH3OH,则通入H2-极为负;
(3)若A为SO2,B为O2,C为H2SO4,则A极的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ、硒是地壳中稀有元素,工业上硒鼓废料(主要成分:硒、碲、碳、铜、铁合金)回收精炼硒的一种工艺流程如下:
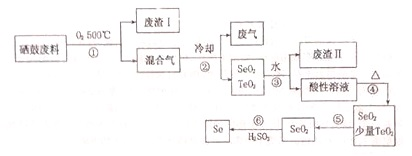
已知:
(1)硒的最高价氧化物对应水化合物化学式:H2SeO4;
(2)废气主要成分是CO2;
(3)步骤④的反应方程式:H2SeO3$\frac{\underline{\;\;△\;\;}}{\;}$SeO2+H2O;步骤⑥的反应方程式:2H2SO3+SeO2=Se+2H2SO4;
(4)根据表中数据,步骤⑤中分离SeO2和TeO2的最佳方案是升华,将温度控制在315℃到450℃之间.
Ⅰ、SO2、CO2转化利用是净化环境,造福人类的有效途径,一种用电化学原理,将SO2、CO2转化成用途广泛的化工产品H2SO4和CH3OH,其装置如图所示:

(1)该装置的工作原理是原电池;(填“原电池”或“电解池”)
(2)若A为CO2,B为H2,C为CH3OH,则通入H2-极为负;
(3)若A为SO2,B为O2,C为H2SO4,则A极的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ、硒是地壳中稀有元素,工业上硒鼓废料(主要成分:硒、碲、碳、铜、铁合金)回收精炼硒的一种工艺流程如下:

已知:
| 物理性质 | 熔点 | 沸点 | 升华 | 溶解性 |
| SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
| TeO2 | 733℃ | 1260℃ | 450℃ | 易溶于水 |
(2)废气主要成分是CO2;
(3)步骤④的反应方程式:H2SeO3$\frac{\underline{\;\;△\;\;}}{\;}$SeO2+H2O;步骤⑥的反应方程式:2H2SO3+SeO2=Se+2H2SO4;
(4)根据表中数据,步骤⑤中分离SeO2和TeO2的最佳方案是升华,将温度控制在315℃到450℃之间.
2.下列叙述中不正确的是( )
| A. | 在离子化合物中也可能存在共价键 | |
| B. | 非金属元素之间的化学键不一定是共价键 | |
| C. | 含离子键的化合物一定是离子化合物 | |
| D. | 含共价键的纯净物一定是共价化合物 |
12.草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加0.01mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)<10 mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| C. | V(NaOH)=10mL时,c(H+)=1×10-7 mol/L | |
| D. | V(NaOH)>10 mL时,c(Na+)>c(HC2O4-)>c(C2O42-) |
16.在8NH3+3Cl2→6NH4Cl+N2反应中,若有10.2gNH3被氧化,则反应用去的氯气在标准状况下体积为( )
| A. | 5.04L | B. | 6.72L | C. | 20.16L | D. | 40.32L |
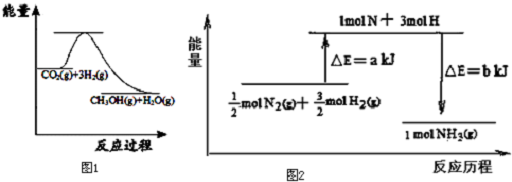
 .
. 煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.
煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择. .
.