题目内容
12.草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加0.01mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)<10 mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| C. | V(NaOH)=10mL时,c(H+)=1×10-7 mol/L | |
| D. | V(NaOH)>10 mL时,c(Na+)>c(HC2O4-)>c(C2O42-) |
分析 A.草酸是二元中强酸,V(NaOH)=0时,NaHC2O4不能完全电离出H+;
B.V(NaOH)<10mL时,溶液中溶质为NaHC2O4、Na2C2O4,若溶液为中性,结合电荷守恒可知c(Na+)=2c(C2O42-)+c(HC2O4-);
C.V(NaOH)=10 mL时,溶液中溶质为Na2C2O4,C2O42-部分水解,溶液显示碱性;
D.V(NaOH)>10 mL时,溶液中溶质为NaOH、Na2C2O4,溶液中c(C2O42-)>c(HC2O4-).
解答 解:A.草酸是二元中强酸,V(NaOH)=0时,NaHC2O4不能完全电离出H+,则c(H+)<1×10-2mol•L-1,故A错误;
B.V(NaOH)<10mL时,溶液中溶质为NaHC2O4、Na2C2O4,当电离等于水解,溶液显示中性,则c(H+)=c(OH-),结合电荷守恒可得:c(Na+)=2c(C2O42-)+c(HC2O4- ),故B正确;
C.V(NaOH)=10 mL时,溶液中溶质为Na2C2O4,溶液显碱性,则c(H+)<1×10-7mol•L-1,故C错误;
D.V(NaOH)>10 mL时,溶液中溶质为NaOH、Na2C2O4,C2O42-水解生成HC2O4-,则离子浓度为c(Na+)>c(C2O42-)>c(HC2O4-),故D错误;
故选B.
点评 本题考查离子浓度大小比较,题目难度中等,明确溶液中的溶质组成为解答的关键,并注意利用溶液中水解的程度及电离的程度、电荷守恒来分析解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列关于能量转化的认识中错误的是( )
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 绿色植物进行光合作用时,太阳能转化为化学能 | |
| C. | 电池充电是将电能转化为化学能 | |
| D. | 燃料电池的能量转化率可达100% |
3.CoxFe3-xO4磁粉是一种比较好的高矫顽力磁粉.工业上以FeSO4为原料制备CoxFe3-xO4的主要步骤如下:
FeSO4$\stackrel{①}{→}$FeOOH晶种$\stackrel{②}{→}$FeOOH$\stackrel{③}{→}$Fe2O3$\stackrel{④}{→}$Fe3O4$→_{⑤}^{CoSO_{4}溶液}$
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH晶种.生成晶种的化学方程式为4FeSO4+8NaOH+O2$\frac{\underline{\;40℃\;}}{\;}$4FeOOH+4Na2SO4+2H2O;
(2)步骤③将FeOOH固体在200~300℃下加热脱水,生成红色Fe2O3.实验室完成该操作需要下列仪器中的cde(填字母).
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(3)步骤④通入H2,加热至300~400℃,生成Fe3O4.通入H2前要向加热炉中通入N2,其作用为排尽装置中的空气,防止氢气与氧气混合反应爆炸.
(4)步骤⑤加入CoSO4溶液,所得粗产品经过滤、洗涤、干燥即得成品.检验粗产品洗涤干净的实验操作和现象是取最后一次洗涤滤出液少许于试管中,滴加氯化钡溶液,如果不产生白色沉淀,则表明洗涤干净.
(5)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的氧化物)制备CoSO4•7H2O晶体.下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
请完成下列实验步骤(可选用的试剂:H2O2、稀硝酸、稀硫酸、NaOH溶液).
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝.
②用稀硫酸溶解LiCoO2,并加入过量H2O2.
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤.
④向③所得滤液中加入NaOH溶液,调节pH至9.4,过滤,洗涤得到Co(OH)2沉淀.
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、降温结晶,得到CoSO4•7H2O晶体.
FeSO4$\stackrel{①}{→}$FeOOH晶种$\stackrel{②}{→}$FeOOH$\stackrel{③}{→}$Fe2O3$\stackrel{④}{→}$Fe3O4$→_{⑤}^{CoSO_{4}溶液}$
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH晶种.生成晶种的化学方程式为4FeSO4+8NaOH+O2$\frac{\underline{\;40℃\;}}{\;}$4FeOOH+4Na2SO4+2H2O;
(2)步骤③将FeOOH固体在200~300℃下加热脱水,生成红色Fe2O3.实验室完成该操作需要下列仪器中的cde(填字母).
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(3)步骤④通入H2,加热至300~400℃,生成Fe3O4.通入H2前要向加热炉中通入N2,其作用为排尽装置中的空气,防止氢气与氧气混合反应爆炸.
(4)步骤⑤加入CoSO4溶液,所得粗产品经过滤、洗涤、干燥即得成品.检验粗产品洗涤干净的实验操作和现象是取最后一次洗涤滤出液少许于试管中,滴加氯化钡溶液,如果不产生白色沉淀,则表明洗涤干净.
(5)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的氧化物)制备CoSO4•7H2O晶体.下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Co2+ | 6.9 | 9.4 |
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝.
②用稀硫酸溶解LiCoO2,并加入过量H2O2.
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤.
④向③所得滤液中加入NaOH溶液,调节pH至9.4,过滤,洗涤得到Co(OH)2沉淀.
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、降温结晶,得到CoSO4•7H2O晶体.
20.如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
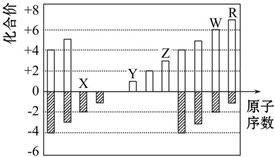

| A. | 原子半径:Z>Y>X | |
| B. | 气态氢化物的稳定性:R<W | |
| C. | WX2和水反应形成的化合物是一种强酸 | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
17.根据元素周期律,由列事实进行归纳推测,推测不合理的是事实( )
| 事实 | 推测 | |
| A | ${\;}_{12}^{\;}$Mg与水反应缓慢,${\;}_{20}^{\;}$Ca与水反应较快 | ${\;}_{56}^{\;}$Ba(DA族)与水反应会更快 |
| B | 是半导体材料,同族的Ge也是半导体材料 | Ⅳ族的元素都是半导体材料 |
| C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
| A. | A | B. | B | C. | C | D. | D |
4.根据A-J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)J的原子结构示意图为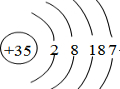 .
.
(2)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na.
(3)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(4)A分别与D、E、F形成的化合物中,最稳定的是NH3.
(5)在C、D、G、H中,原子半径最大的是Al.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H | ||||
| 4 | J |
 .
.(2)表中元素,化学性质最不活泼的是Ne,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na.
(3)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3.
(4)A分别与D、E、F形成的化合物中,最稳定的是NH3.
(5)在C、D、G、H中,原子半径最大的是Al.
1.化学与社会、生活密切相关,下列有关说法不正确的是( )
| A. | 利用清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 食品添加剂种类很多,其中的一种为苯甲酸钠,它是苯的一种同系物所对应的钠盐 | |
| C. | 某些蔬菜和水果在人体代谢后,生成碱性物质,所以称为碱性食物 | |
| D. | 抗酸药的种类很多,如碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝、氢氧化镁等 |
2.恒温条件下用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
| A. | $\frac{{c(O{H^-})}}{{c(N{H_3}•{H_2}O)}}$ | B. | $\frac{{c(N{H_3}•{H_2}O)}}{{c(O{H^-})}}$ | ||
| C. | c(H+)和c(OH--)的乘积 | D. | OH-的物质的量 |