题目内容
12.下表为元素周期表的一部分,列出了10种元素在元素周期表中的位置.试回答下列问题: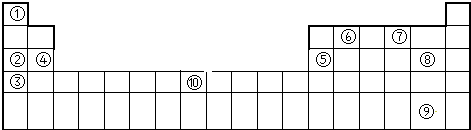
(1)元素⑦的氢化物分别与②和⑧的单质反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,Cl2+H2O=H++Cl-+HClO.
(2)元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为:NaOH+Al(OH)3=NaAlO2+2H2O.
(3)元素⑩的原子序数为26,该元素在地壳中的含量居第四位,是目前应用最广泛的一种金属,其单质与⑧的氢化物的水溶液反应的离子方程式为Fe+2H+=Fe2++H2↑.
(4)⑥与⑧形成化合物的化学式为CCl4,单质⑨溶于该化合物所得溶液呈紫色.
分析 根据元素在周期表中的位置可知,①为H、②为Na、③为K、④为Mg、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为I、⑩为Fe,
(1)⑦为O元素,其氢化物为H2O,②的单质为金属Na,⑧的单质为Cl2,钠与水反应生成氢氧化钠和氢气;氯气和水反应生成盐酸和次氯酸,次氯酸是弱酸,离子方程式中需要保留化学式;
(2)②为Na、⑤为Al,二者的最高价氧化物对应的水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠和水;
(3)元素⑩是第26号元素Fe;铁与盐酸反应生成氯化亚铁和氢气;
(4)⑥与⑧形成化合物的化学式为CCl4;碘单质溶于四氯化碳,溶液呈紫色.
解答 解:由元素在周期表中的位置可知,①为H、②为Na、③为K、④为Mg、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为I、⑩为Fe,
(1)⑦为O元素,其氢化物为H2O,②的单质为金属Na,⑧的单质为Cl2,钠与水反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑;
氯气和水反应生成盐酸和次氯酸,次氯酸是弱酸,反应的离子方程式:Cl2+H2O=H++Cl-+HClO,
故答案为:2Na+2H2O═2Na++2OH-+H2↑;Cl2+H2O=H++Cl-+HClO;
(2)②为Na、⑤为Al,二者的最高价氧化物对应的水化物分别为氢氧化钠、氢氧化铝,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应方程式为:NaOH+Al(OH)3=NaAlO2+2H2O,
故答案为:NaOH+Al(OH)3=NaAlO2+2H2O;
(3)元素⑩为Fe,位于周期表中第四周期ⅤⅢ族,其原子序数为26;⑧为Cl元素,其氢化物为HCl,铁与盐酸反应生成氯化亚铁和氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑,
故答案为:26;Fe+2H+=Fe2++H2↑;
(4)⑥与⑧形成化合物的化学式为CCl4,单质⑨为碘单质,碘单质溶于四氯化碳,溶液呈紫色,
故答案为:CCl4;紫.
点评 本题考查了元素周期表与元素周期律的综合应用,题目难度中等,该烃为高考的高频题,熟练掌握元素周期表结构、元素周期律的内容为解答关键,要求学生能够正确书写常见反应的化学方程式、离子方程式,.

| A. | 在氧化还原反应中,甲失电子比乙失电子多 | |
| B. | 甲在化合物中的化合价比乙在化合物中的高 | |
| C. | 甲能与稀盐酸反应生成氢气,而乙不能 | |
| D. | 甲与乙组成原电池时,甲为正极 |
| A. | C2H6O | B. | C3H6O | C. | C2H3Br | D. | C2H4 Br2 |
| A. | 在该溶液中:Na+、SO42-、CH2O、Mg2+可以大量共存 | |
| B. | 该溶液中Fe3+的检验:Fe3++3SCN-=Fe(SCN)3↓ | |
| C. | 与NaHCO3溶液混合:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑ | |
| D. | 每腐蚀32gCu需要1mol/L该溶液500mL |
| A. | KI溶液中:Ca2+、Na+、ClO-、Cl- | |
| B. | 滴入酚酞试液显红色的溶液中:Al3+、K+、AlO2-、SO42- | |
| C. | c(H+)=10-12mol•L-1的溶液中:K+、Na+、NO3-、Cl- | |
| D. | 加入铝粉产生氢气的溶液中:Na+、Mg2+、HCO3-、SO42- |
| 事实 | 推测 | |
| A | 12Mg与水反应缓慢,20Ca与水反应较快 | 56Ba(IIA族)与水反应更快 |
| B | Si是半导体材料,同族Ge也是半导体材料 | Ⅳ族的元素都是半导体材料, |
| C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
| A. | A | B. | B | C. | C | D. | D |
