题目内容
【题目】运用相关原理,回答问题:
Ⅰ.(1)25℃时,水的离子积Kw值为____________。
(2)在T℃的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如图所示:

①T℃下,水的离子积为_______________。
②T℃下,0.01 mol/L NaOH溶液中c(H+) 为____________mol/L。
Ⅱ.25℃时,电离平衡常数如下。回答下列问题:
化学式 | CH3COOH | H2S | HClO |
电离平衡常数 | 1.8×10-5 | K1=1.3×10-7 K2=7.1×10-15 | 3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种物质:
a.Na2S b.NaClO c.CH3COONa d.NaHS
pH由大到小的顺序是____________________(填序号)。
(2)25℃时,0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是___________________。
a.c(H+) b.c(H+)/c(CH3COOH) c.c(H+)·c(OH-)
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中 c(CH3COO-)-c(Na+)=______________mol/L(填数值)。
【答案】 10-14 10-15 10-13 a﹥b﹥d﹥c a 9.9×10-7或(10-6-10-8)
【解析】试题分析:Ⅰ.(1)25℃时,水的离子积Kw为![]() ;(2)①水的离子积Kw=
;(2)①水的离子积Kw= ![]() ;②T℃下,0.01 mol/L NaOH溶液中c(OH-)= 0.01 mol/L ,根据c(H+)=
;②T℃下,0.01 mol/L NaOH溶液中c(OH-)= 0.01 mol/L ,根据c(H+)=  计算;Ⅱ.(1)根据电离平衡常数判断酸性强弱,越弱水解程度越大,越弱PH越大;(2)CH3COOH溶液加水稀释过程,醋酸电离平衡正向移动,c(H+)减小,c(OH-)增大,Kw不变;(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则c(OH-)= 10-8 mol/L、c(H+)=10-6,根据电荷守恒计算溶液中 c(CH3COO-)-c(Na+)的值。
计算;Ⅱ.(1)根据电离平衡常数判断酸性强弱,越弱水解程度越大,越弱PH越大;(2)CH3COOH溶液加水稀释过程,醋酸电离平衡正向移动,c(H+)减小,c(OH-)增大,Kw不变;(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则c(OH-)= 10-8 mol/L、c(H+)=10-6,根据电荷守恒计算溶液中 c(CH3COO-)-c(Na+)的值。
解析:Ⅰ.(1)25℃时,水的离子积Kw为![]() ;(2)①水的离子积Kw=
;(2)①水的离子积Kw= ![]() =
=![]() ;②T℃下,0.01 mol/L NaOH溶液中c(OH-)= 0.01 mol/L , c(H+)=
;②T℃下,0.01 mol/L NaOH溶液中c(OH-)= 0.01 mol/L , c(H+)=  ;Ⅱ.(1)根据电离平衡常数,酸性CH3COOH> H2S > HClO > HS- ,越弱越水解,越水解PH越大,所以pH由大到小的顺序是Na2S﹥NaClO﹥NaHS﹥CH3COONa;(2)A.CH3COOH溶液加水稀释过程,c(H+)减小,故A选;B.c(H+)/c(CH3COOH)=n(H+)/n(CH3COOH),则稀释过程中促进电离比值变大,故B不选;C.Kw只与无关有关,稀释过程,Kw不变,故C不选;(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,,则c(OH-)= 10-8 mol/L、c(H+)=10-6,根据电荷守恒,c(CH3COO-)+ c(OH-)= c(H+)+c(Na+) c(CH3COO-)-c(Na+)= c(H+) -c(OH-)= 10-6-10-8=9.9×10-7。
;Ⅱ.(1)根据电离平衡常数,酸性CH3COOH> H2S > HClO > HS- ,越弱越水解,越水解PH越大,所以pH由大到小的顺序是Na2S﹥NaClO﹥NaHS﹥CH3COONa;(2)A.CH3COOH溶液加水稀释过程,c(H+)减小,故A选;B.c(H+)/c(CH3COOH)=n(H+)/n(CH3COOH),则稀释过程中促进电离比值变大,故B不选;C.Kw只与无关有关,稀释过程,Kw不变,故C不选;(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,,则c(OH-)= 10-8 mol/L、c(H+)=10-6,根据电荷守恒,c(CH3COO-)+ c(OH-)= c(H+)+c(Na+) c(CH3COO-)-c(Na+)= c(H+) -c(OH-)= 10-6-10-8=9.9×10-7。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是_______,说明氧化性Ag+>Cu2+。
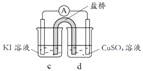
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
实验 | 试剂 | 编号及现象 | |
试管 | 滴管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
① 经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
② 经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:
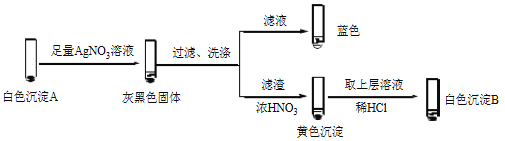
a.检验滤液无I2。溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是____,说明氧化性Ag+>Cu2+。
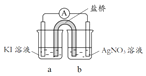
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
编号 | 实验1 | 实验2 | 实验3 |
实验 |
|
|
|
现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极 上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黄色的原因是_______(用电极反应式表示)。
② “实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_______。
③ 方案2中,Cu2+能氧化I-,而Ag+未能氧化I-的原因:_______。
(资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108)