题目内容
【题目】下列物质中,通常用电解法冶炼的是( )
A.AgB.CuC.NaD.Fe
【答案】C
【解析】
A.银属于不活泼的金属,采用热分解法冶炼,故A不符合题意;
B.工业上用热还原法冶炼铜,故B不符合题意;
C.钠的性质很活泼,采用电解其熔融盐的方法冶炼,故C符合题意;
D.工业上用还原剂还原氧化铁,铁采用热还原法冶炼,故D不符合题意;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
i. CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
ii. CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
iii. CO2(g)+H2(g)![]() CO (g)+H2O(g) △H3
CO (g)+H2O(g) △H3
回答下列问题:
(1)已知反应ii中的相关的化学键键能(“C![]() O”表示CO的化学键)数据见表:
O”表示CO的化学键)数据见表:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H2=______________。
(2)反应i、ii、iii对应的平衡常数K1、K2、K3之间的关系式为_______________
(3)一定条件下,在2L的恒容密闭容器中充入1molCO2和2molH2发生反应i 。下图是反应体系中CO2的平衡转化率与温度的关系曲线。

①△H1_____0(填“大于”或“小于”)
②当温度为500K时,该反应10min达到平衡。0~10min时间内用CH3OH表示该反
应的化学反应速率为_____________________。
③若改充入1mol CO2和3mol H2,则图中的曲线会_________(填“上移”或“下移”)。
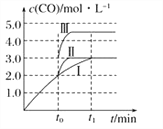
(4)在3 L容积可变的密闭容器中发生反应iii,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是______;当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_______。
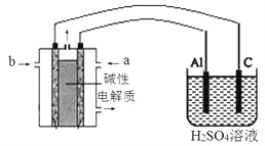
(5)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质b是__________, 阳极电极反应为_______________。
【题目】运用相关原理,回答问题:
Ⅰ.(1)25℃时,水的离子积Kw值为____________。
(2)在T℃的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如图所示:

①T℃下,水的离子积为_______________。
②T℃下,0.01 mol/L NaOH溶液中c(H+) 为____________mol/L。
Ⅱ.25℃时,电离平衡常数如下。回答下列问题:
化学式 | CH3COOH | H2S | HClO |
电离平衡常数 | 1.8×10-5 | K1=1.3×10-7 K2=7.1×10-15 | 3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的下列四种物质:
a.Na2S b.NaClO c.CH3COONa d.NaHS
pH由大到小的顺序是____________________(填序号)。
(2)25℃时,0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是___________________。
a.c(H+) b.c(H+)/c(CH3COOH) c.c(H+)·c(OH-)
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中 c(CH3COO-)-c(Na+)=______________mol/L(填数值)。