题目内容
【题目】Mn2O3是一种重要的工业原料,在电磁和有机合成等领域应用广泛。某学习小组在实验室用CH4还原MnO2制备Mn2O3,并测定产品纯度。请回答下列问题:
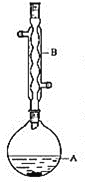
Ⅰ.制备(实验装置如图所示)

已知:Al4C3+12H2O==4Al(OH)3+3CH4↑。
(1)仪器a的名称为______________________
(2)连接好实验装置,检验装置的气密性并加入相应试剂。向烧瓶中滴加稀醋酸之后,在点燃酒精灯之前应进行的操作是____
(3)仪器b中同时生成两种能参与大气循环的物质,该反应的化学方程式为_______
Ⅱ.测定产品中Mn2O3的纯度(只考虑产品中混有少量未参与反应的MnO2)
ⅰ.实验结束后,取仪器b中所得固体7.19g,加入足量硫酸酸化的KI溶液,使固体中锰元素全部转化为Mn2+;(步骤ⅰ中发生反应的离子方程式为:Mn2O3+2I- +6H+==2Mn2++ I2+ 3H2O MnO2+2I- + 4H+==Mn2++ I2+ 2H2O )
ⅱ.将所得溶液稀释至500mL;
ⅲ.取25.00mL稀释后的溶液,滴加几滴淀粉溶液,用0.200molL-1的Na2S2O3标准溶液滴定,达到滴定终点时,消耗25.00mLNa2S2O3标准溶液。
(已知:I2+2 Na2S2O3==Na2S4O6+2NaI)
(4)滴定终点的标志是__________________________
(5)所取固体中Mn2O3的质量分数为___________________(计算结果精确到0.1%)
(6)下列操作使测定结果偏高的是______________
A.滴定前平视,滴定终点俯视读数
B.盛放Na2S2O3标准溶液的滴定管未用标准液润洗
C.硫酸酸化的KI溶液在空气中静置时间过长
D.滴定前正常,滴定后滴定管尖嘴内有气泡
【答案】球形干燥管 在装置出口处收集气体验纯 ![]() 最后一滴
最后一滴![]() 标准溶液滴入,溶液由蓝色变为无色,且半分钟不变色 87.9% AD
标准溶液滴入,溶液由蓝色变为无色,且半分钟不变色 87.9% AD
【解析】
(1)仪器名称为球形干燥管;
(2)在点燃酒精灯之前应进行的操作是检验气体纯度避免加热过程中发生爆炸;
(3)CH4还原MnO2制备Mn2O3,仪器b中同时生成两种能参与大气循环的物质是甲烷和二氧化锰反应生成二氧化碳水和Mn2O3;
(4)碘遇到淀粉变蓝色,据此分析判断反应终点;
(5)由得失电子守恒可知2n(Na2S2O3)=n(I2)=n(Mn2O3+MnO2),结合反应的定量关系计算碘单质物质的量,设b中所得固体7.19g中Mn2O3物质的量为x,MnO2物质的量为y,列式计算得到;
(6)A.滴定前平视,滴定终点俯视读数,读取标准溶液体积偏低;
B.盛放Na2S2O3标准溶液的滴定管未用标准液润洗,消耗标准溶液体积偏大;
C.硫酸酸化的KI溶液在空气中静置时间过长,碘离子被空气中氧气氧化,消耗锰氧化物偏低;
D.滴定前正常,滴定后滴定管尖嘴内有气泡,消耗标准溶液体积读取偏低。
(1)仪器a的名称为:球形干燥管,故答案为:球形干燥管;
(2)连接好实验装置,检验装置的气密性并加入相应试剂。向烧瓶中滴加稀醋酸之后,在点燃酒精灯之前应进行的操作是:在装置出口处收集气体验纯,故答案为:在装置出口处收集气体验纯;
(3)CH4还原MnO2制备Mn2O3,仪器b中同时生成两种能参与大气循环的物质是甲烷和二氧化锰反应生成二氧化碳水和Mn2O3,反应的化学方程式:![]() ;故答案为:
;故答案为:![]() ;
;
(4)取25.00mL稀释后的溶液,滴加几滴淀粉溶液,用0.200molL-1的![]() 标准溶液滴定,达到滴定终点时,消耗25.00mLNa2S2O3标准溶液,滴定终点的标志是:最后一滴
标准溶液滴定,达到滴定终点时,消耗25.00mLNa2S2O3标准溶液,滴定终点的标志是:最后一滴![]() 标准溶液滴入,溶液由蓝色变为无色,且半分钟不变色;
标准溶液滴入,溶液由蓝色变为无色,且半分钟不变色;
故答案为:最后一滴Na2S2O3标准溶液滴入,溶液由蓝色变为无色,且半分钟不变色;
(5)设b中所得固体7.19g中Mn2O3物质的量为x,MnO2物质的量为y则158x+87y=7.19,由得失电子守恒可知2n(Na2S2O3)=n(I2)=n(Mn2O3+MnO2),Na2S2O3物质的量为![]() ,稀释20倍后,则x+y=0.05,解得x=0.04mol;y=0.01mol,所取固体中Mn2O3的质量分数
,稀释20倍后,则x+y=0.05,解得x=0.04mol;y=0.01mol,所取固体中Mn2O3的质量分数![]() ×100%=87.9%;
×100%=87.9%;
故答案为:87.9%;
(6)A.滴定前平视,滴定终点俯视读数,读取标准溶液体积减小,测定碘单质物质的量偏低,计算得到Mn2O3的合理偏高,故A正确;
B.盛放Na2S2O3标准溶液的滴定管未用标准液润洗,消耗标准溶液体积增大,测定碘单质物质的量偏高,计算得到Mn2O3的合理偏低,故B错误;
C.硫酸酸化的KI溶液在空气中静置时间过长,碘离子被空气中氧气氧化,消耗标准溶液体积偏大,计算消耗氧化物的量减少,结果偏低,故C错误;
D.滴定前正常,滴定后滴定管尖嘴内有气泡,消耗标准溶液体积读取偏低,待测液中碘单质外电路偏低,计算得到Mn2O3的合理偏高,故D正确;
故答案为:AD。

 名校课堂系列答案
名校课堂系列答案【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应:
![]() +
+![]()
![]()
![]() +H2O
+H2O
装置示意图为:
有关数据如下:
相对分子质量 | 密度/(gcm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:
在A中加入![]() 异戊醇
异戊醇![]() 、数滴浓硫酸和
、数滴浓硫酸和![]() 片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水
片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水![]() 固体,静置片刻,过滤除去
固体,静置片刻,过滤除去![]() 固体,进行蒸馏纯化,收集
固体,进行蒸馏纯化,收集![]() 馏分,得乙酸异戊脂
馏分,得乙酸异戊脂![]()
回答下列问题:
(1)仪器B的名称是_________
(2)在洗涤操作中,第一次水洗的主要目的是_____。第二次水洗的主要目的是_____
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号)_______
a、直接将乙酸异戊脂从分液漏斗的上口倒出
b、直接将乙酸异戊从分液端斗的下口放出
c、先将水层从分液漏斗的下口放出,再将乙酸异戊脂从下口放出
d、先将水层从分液漏斗的下口放出,再将乙酸异戊酚从上口倒出
(4)本实验中加入过量乙酸的目的是_____________
(5)实验中加入少量无水![]() 的目的是____________
的目的是____________
(6)在蒸馏操作中,仪器选择及安装都正确的是_________![]() 填标号
填标号![]() 。
。
a. 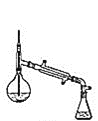 b.
b. 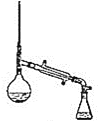 c.
c. 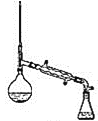 d.
d. 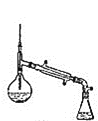
(7)本实验的产率是________![]() 填标号
填标号![]()
![]() .
.![]() .
.![]()
(8)在进行蒸馏操作时:若从![]() 便开始收集馏分,会使实验的产率偏_________
便开始收集馏分,会使实验的产率偏_________![]() 填“高”或“低”
填“高”或“低”![]() ,其原因是___________
,其原因是___________
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ |
② | 0 | 0 | 1 | 4 | 热量变化:QkJ |
下列说法中,不正确的是( )
A.容器①中反应达平衡时,CO的转化率为80%
B.容器①中CO的转化率等于容器②中CO2的转化率
C.平衡时,两容器中CO2的浓度相等
D.容器①时CO的反应速率等于H2O的反应速率
【题目】大气中的氮氧化物![]() 、
、![]() 、
、![]() 等的含量高低是衡量空气质量优劣的重要指标,对其研究和综合治理具有重要意义。
等的含量高低是衡量空气质量优劣的重要指标,对其研究和综合治理具有重要意义。
![]() 汽车发动机工作时会引发反应:
汽车发动机工作时会引发反应:![]() ,
,![]() ,其能量变化示意图如下:
,其能量变化示意图如下:
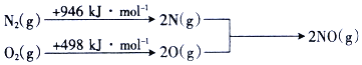
则NO中氮氧键的键能为______![]() 。
。
![]() 以碱液为电解质可实现如下转化:
以碱液为电解质可实现如下转化:![]()
![]()
![]() ,
,![]() 该反应在一定条件下能自发进行的原因是______,阴极反应式为______。
该反应在一定条件下能自发进行的原因是______,阴极反应式为______。
![]() 将
将![]() 和
和![]() 溶于水可得到相应的酸
溶于水可得到相应的酸![]() 时,两种酸的电离平衡常数如表:
时,两种酸的电离平衡常数如表:
|
| |
|
|
|
|
|
|
①![]() 的水解平衡常数为______。
的水解平衡常数为______。
②![]() 溶液和
溶液和![]() 溶液反应的离子方程式为______。
溶液反应的离子方程式为______。
![]() 汽车尾气处理催化装置中涉及的反应之一为:
汽车尾气处理催化装置中涉及的反应之一为:![]() ,
,![]() 研究表明,在使用等质量的催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了以下三组实验:
研究表明,在使用等质量的催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了以下三组实验:
实验 编号 |
| NO初始浓度 | CO初始浓度 | 催化剂比表面积 |
Ⅰ | 400 |
|
| 82 |
Ⅱ | 400 |
|
| 124 |
Ⅲ | 450 |
|
| 124 |
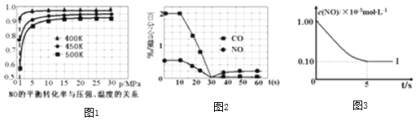
根据下列坐标图,计算前5s内用![]() 表示的反应速率为______;并在坐标图中画出上表实验Ⅱ、Ⅲ条件下,混合气体中NO浓度随时间变化的趋势
表示的反应速率为______;并在坐标图中画出上表实验Ⅱ、Ⅲ条件下,混合气体中NO浓度随时间变化的趋势![]() 标明各条曲线的实验编号
标明各条曲线的实验编号![]() 。______
。______