题目内容
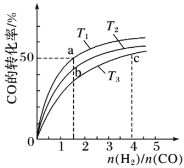
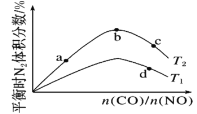
【题目】一定条件下,反应:![]() 的数据如图所示。下列说法正确的是( )
的数据如图所示。下列说法正确的是( )

A.该反应的![]()
B.达到平衡时,![]()
C.b点对应的平衡常数K值大于c点
D.a点对应的![]() 的平衡转化率为90%
的平衡转化率为90%
【答案】D
【解析】
根据题干所给图象,可以看出平衡转化率随温度升高而降低,从而判断出该反应是放热反应。
A.由图可知,反应物起始物质的量之比一定时,温度升高,![]() 的平衡转化率降低,平衡逆向移动,则有
的平衡转化率降低,平衡逆向移动,则有![]() ,A项错误;
,A项错误;
B.达到平衡时,由反应速率与化学计量数的关系可得,![]() ,B项错误;
,B项错误;
C.图中b点温度高于c点,而温度升高,平衡逆向移动,平衡常数减小,故b点对应的平衡常数K值小于c点,C项错误;
D.图中a点![]() 的平衡转化率为60%,曲线Ⅰ中
的平衡转化率为60%,曲线Ⅰ中![]() ,设起始时
,设起始时![]() ,则
,则![]() ,反应中消耗的
,反应中消耗的![]() 为1
为1![]() ,则a点对应的
,则a点对应的![]() 的平衡转化率为
的平衡转化率为![]() ,D项正确。
,D项正确。
答案选D。

练习册系列答案
相关题目