题目内容
18.以下转化不能通过一步反应实现的是( )| A. | SiO2→SiF4 | B. | Al2O3→Al(OH)3 | C. | Fe→FeCl2 | D. | SiO2→CaSiO3 |
分析 A.二氧化硅和氢氟酸反应生成;
B.氧化铝不能溶于水生成氢氧化铝;
C.铁和盐酸反应生成氯化亚铁;
D.二氧化硅与碳酸钙反应生成硅酸钙和二氧化碳.
解答 解:A.二氧化硅和氢氟酸反应生成四氟化硅和水,能一步实现,故A不选;
B.因氧化铝不溶于水,也不与水反应,则不能一步反应实现转化,应氧化铝与氢氧化钠反应后通入足量二氧化碳来生成氢氧化铝,故B选;
C.铁和盐酸反应生成氯化亚铁和氢气,能一步反应完成,故C不选;
D.二氧化硅与碳酸钙反应生成硅酸钙和二氧化碳,能一步反应完成,故D不选;
故选B.
点评 本题考查物质的转化,明确物质的化学性质及相关的化学反应是解答本题的关键,题目难度不大.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
9.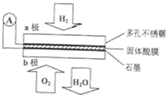 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )
 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法错误的是( )| A. | 电子通过外电路从a极流向b极 | |
| B. | b极上的电极反应式为:O2+4H++4e-═2H2O | |
| C. | H+由b极通过固体酸电解质传递到a极 | |
| D. | 每转移0.1 mol电子,标准状况下需消耗1.12L的H2 |
6.实验室用铜和浓硫酸反应制取二氧化硫,下列有关该反应的说法错误的是( )
| A. | 铜是还原剂,发生了氧化反应 | |
| B. | 每生成1 mol SO2,转移电子的物质的量是2 mol | |
| C. | 每消耗 1 mol Cu,起氧化剂作用的硫酸消耗2 mol | |
| D. | 反应后物质中可能有白色固体出现 |
3.下列各组离子在溶液中按括号内的物质的量之比混合,得到无色、碱性、澄清溶液的是( )
| A. | Fe3+、Na+、Cl-、S2- (1:2:3:1) | B. | K+、Cu2+、OH-、SO42- (1:1:1:1) | ||
| C. | NH4+、H+、I -、HCO3- (1:1:1:1) | D. | Na+、Al 3+、Cl -、OH-(4:1:3:4) |
10.能用来分离Fe3+和Al3+离子的试剂是( )
| A. | KSCN | B. | NH3•H2O | C. | NaOH溶液 | D. | H2S溶液 |
8.下列实验操作中,正确的是( )
| A. | 稀释浓硫酸时,可先在量筒中加入一定体积蒸馏水,再沿量筒内壁慢慢注入浓硫酸,并用玻璃棒不断搅拌 | |
| B. | 过滤时,玻璃棒的末端应轻轻靠在三层滤纸的一边,漏斗里的溶液应低于滤纸的边缘 | |
| C. | 燃着的酒精灯不慎打翻,应立即用水灭火 | |
| D. | 用药匙或纸槽把粉末状药品送入到试管的底部,如果没有试管夹,可以临时手持试管给固体加热 |
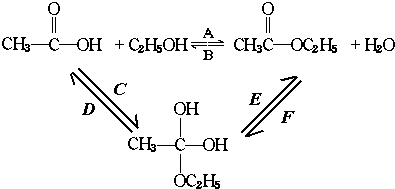
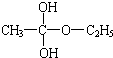 再转化为酯和水,以上反应均为可逆反应,回答下列问题:
再转化为酯和水,以上反应均为可逆反应,回答下列问题: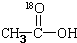 进行该实验,18O可存在于哪些物质中A、C
进行该实验,18O可存在于哪些物质中A、C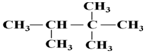 :2,2,3-三甲基丁烷;
:2,2,3-三甲基丁烷;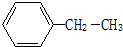 乙苯
乙苯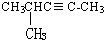 4-甲基-2-戊炔.
4-甲基-2-戊炔.