题目内容
【题目】乙烷是一种重要的化工原料,可用作制冷剂、燃料、制备乙烯的原料。
请回答下列问题:
I.乙烷蒸汽裂解技术是工业上应用成熟的乙烯制备方法:C2H6(g)![]() C2H4(g)+H2(g) △H。
C2H4(g)+H2(g) △H。
(1)已知:C2H6(g)、H2(g)和CH2CH2(g)的标准燃烧热分别是1560kJ·mol-1、285.8kJ·mol-1和1411.0kJ·mol-1,则△H=___。
(2)1000℃时,在某刚性密闭容器内充入一定量的C2H6(g),只发生反应C2H6(g)![]() CH2=CH2(g)+H2(g)△H,若平衡时容器中总压为pPa,乙烷的转化率为α,则该反应的平衡常数KP=__Pa(用含p、α的代数式表示,KP为用分压表示的平衡常数)。已知1000℃时该反应的KP=4×104Pa,若p=2.1×105,则α=__。达到平衡后,欲同时增大反应速率和α,可采取的措施有__(填选项字母)。
CH2=CH2(g)+H2(g)△H,若平衡时容器中总压为pPa,乙烷的转化率为α,则该反应的平衡常数KP=__Pa(用含p、α的代数式表示,KP为用分压表示的平衡常数)。已知1000℃时该反应的KP=4×104Pa,若p=2.1×105,则α=__。达到平衡后,欲同时增大反应速率和α,可采取的措施有__(填选项字母)。
A.升高温度 B.通入惰性气体
C.增加乙烷浓度 D.加入催化剂
II.乙烷催化氧化裂解法是一种新型的制备乙烯的方法:C2H6(g)+![]() O2(g)
O2(g)![]() C2H4(g)+H2O(g)△H=-149kJ·mol-1。
C2H4(g)+H2O(g)△H=-149kJ·mol-1。
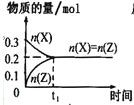
(3)在乙烷氧化过程中,若![]() 过高,则会导致乙烷转化率降低,且易形成积碳。800℃时,当n(C2H6)和n(O2)的混合气以一定流速通过反应器时,混合气中
过高,则会导致乙烷转化率降低,且易形成积碳。800℃时,当n(C2H6)和n(O2)的混合气以一定流速通过反应器时,混合气中![]() 的比值对乙烷氧化裂解制乙烯的反应性能的影响如图1所示:
的比值对乙烷氧化裂解制乙烯的反应性能的影响如图1所示:
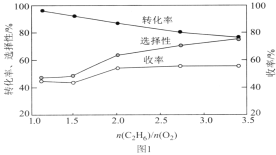
①n![]() 的最佳比值应为__。
的最佳比值应为__。
②![]() 较低时,生成乙烯的选择性较低的原因可能为__。
较低时,生成乙烯的选择性较低的原因可能为__。
Ⅲ.我国科学家利用固体氧化物电解池成功实现了乙烷电化学脱氢制备乙烯,装置如图2所示:
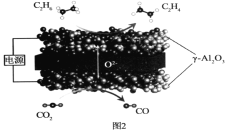
(4)通入CO2的电极为___极(填“阳”或“阴”);C2H6生成C2H4的电极反应式为__。
【答案】+136.8kJ·mol-1 ![]() 0.4(或40%) A 2:1(或2.0) 乙烷发生深度氧化(或副反应增多) 阴 C2H6-2e-+O2-=C2H4+H2O
0.4(或40%) A 2:1(或2.0) 乙烷发生深度氧化(或副反应增多) 阴 C2H6-2e-+O2-=C2H4+H2O
【解析】
燃烧热是指1mol可燃物燃烧生成稳定氧化物所放出的热量,则①C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) △H1=-1560kJ·mol-1;②H2(g)+
O2(g)=2CO2(g)+3H2O(l) △H1=-1560kJ·mol-1;②H2(g)+![]() O2(g)= H2O(l) △H2=-285.8kJ·mol-1③CH2CH2(g)+3O2(g)=2CO2(g)+2H2O(l) △H3=-1411.0kJ·mol-1。要增大乙烷的转化率则要让反应正向移动;由电解池装置可知,二氧化碳反应生成一氧化碳,碳元素化合价降低,发生还原反应;C2H6生成C2H4,碳元素化合价升高,发生氧化反应。
O2(g)= H2O(l) △H2=-285.8kJ·mol-1③CH2CH2(g)+3O2(g)=2CO2(g)+2H2O(l) △H3=-1411.0kJ·mol-1。要增大乙烷的转化率则要让反应正向移动;由电解池装置可知,二氧化碳反应生成一氧化碳,碳元素化合价降低,发生还原反应;C2H6生成C2H4,碳元素化合价升高,发生氧化反应。
(1)根据盖斯定律,反应C2H6(g)![]() C2H4(g)+H2(g)可由①-②-③得到,则△H=△H1-△H2-△H3=-1560kJ·mol-1+285.8kJ·mol-1+1411.0kJ·mol-1=+136.8kJ·mol-1。
C2H4(g)+H2(g)可由①-②-③得到,则△H=△H1-△H2-△H3=-1560kJ·mol-1+285.8kJ·mol-1+1411.0kJ·mol-1=+136.8kJ·mol-1。
(2)反应C2H6(g)![]() CH2=CH2(g)+H2(g),设开始时压强为P0,乙烷的转化率为α,则反应的乙烷的压强为αP0,平衡时的压强为(P0-αP0),生成的乙烯和氢气的压强为αP0,若平衡时容器中总压为pPa,即(P0-αP0+2αP0)=p,则P0=
CH2=CH2(g)+H2(g),设开始时压强为P0,乙烷的转化率为α,则反应的乙烷的压强为αP0,平衡时的压强为(P0-αP0),生成的乙烯和氢气的压强为αP0,若平衡时容器中总压为pPa,即(P0-αP0+2αP0)=p,则P0=![]() ,该反应的平衡常数KP=
,该反应的平衡常数KP=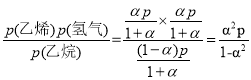 。已知1000℃时该反应的KP=4×104Pa,若p=2.1×105,则
。已知1000℃时该反应的KP=4×104Pa,若p=2.1×105,则![]() =4×104Pa,α=0.4。达到平衡后,欲同时增大反应速率和α,即既要增大反应速率又要让平衡正向移动,反应为吸热反应,升高温度反应速率增大,α增大;恒容恒温条件下,通入惰性气体,化学反应速率不变;增加乙烷浓度,反应速率增大,但α减小;加入催化剂,反应速率增大,但α不变。
=4×104Pa,α=0.4。达到平衡后,欲同时增大反应速率和α,即既要增大反应速率又要让平衡正向移动,反应为吸热反应,升高温度反应速率增大,α增大;恒容恒温条件下,通入惰性气体,化学反应速率不变;增加乙烷浓度,反应速率增大,但α减小;加入催化剂,反应速率增大,但α不变。
(3)①根据图像和已知条件:若![]() 过高,则会导致乙烷转化率降低,且易形成积碳,n
过高,则会导致乙烷转化率降低,且易形成积碳,n![]() =2:1(或2.0)时反应物转化率较高,不易形成积碳,为最佳比值。
=2:1(或2.0)时反应物转化率较高,不易形成积碳,为最佳比值。
②![]() 较低时,生成乙烯的选择性较低,主要是因为乙烷发生深度氧化(或副反应增多)。
较低时,生成乙烯的选择性较低,主要是因为乙烷发生深度氧化(或副反应增多)。
(4)电解池阴极发生还原反应,综上分析,二氧化碳在阴极发生还原反应,C2H6失电子与电解液中的O2-反应生成C2H4,电极反应式为C2H6-2e-+O2-=C2H4+H2O。