题目内容
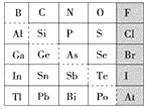
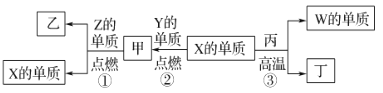
【题目】X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,W的单质为常见的半导体材料,X、W为同一主族元素。X、Z、W分别与Y形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断正确的是( )
A.X的氢化物沸点低于Y的氢化物沸点
B.W的单质可以用作计算机芯片,太阳能电池,丙是玛瑙的主要成分
C.甲、丙、丁均为酸性化合物
D.工业上用X的单质和乙来制取Z单质
【答案】B
【解析】
X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,可在甲中燃烧生成X的单质,应为镁与二氧化碳的反应,则Z为Mg,甲为CO2,乙为MgO,由此关系可知X为C元素,W的单质为常见的半导体材料,X、W为同一主族元素,则W为Si,Y为O元素,丁为CO,丙为SiO2,以此解答该题。
A. X的氢化物为烃,Y的氢化物为水,烃的种类很多,其沸点不一定低于水,故A错误;
B. W为Si,是良好的半导体材料,可以用作计算机芯片、太阳能电池,丙为二氧化硅,是玛瑙的主要成分,故B正确;
C. 丁为CO,不能与碱反应生成盐和水,所以不是酸性氧化物,故C错误;
D. 工业用电解质熔融的氯化镁的方法冶炼镁,故D错误;
故选B。

练习册系列答案
相关题目