题目内容
【题目】已知299 K时,合成氨反应 N2(g ) + 3H2 ( g )![]() 2NH3( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJB. 一定等于92.0 kJ
C. 一定小于92.0 kJD. 不能确定
【答案】C
【解析】
N2(g ) + 3H2( g )![]() 2NH3( g ) △H = -92.0 kJ/mol指299K,1molN2与3molH2完全反应生成2molNH3放出92.0kJ的热量;由于该反应为可逆反应,反应物的转化率小于100%,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量一定小于92.0kJ,答案选C。
2NH3( g ) △H = -92.0 kJ/mol指299K,1molN2与3molH2完全反应生成2molNH3放出92.0kJ的热量;由于该反应为可逆反应,反应物的转化率小于100%,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量一定小于92.0kJ,答案选C。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案【题目】硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4·FeSO4·6H2O,是一种复盐(又称摩尔盐)。一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体,三种盐的溶解度(单位为g/100gH2O)见下表:
温度℃ | FeSO4·7H2O | (NH4)2SO4 | (NH4)2SO4·FeSO4·6H2O |
10 | 20.0 | 73.0 | 17.2 |
20 | 26.5 | 75.4 | 21.6 |
30 | 32.9 | 78.0 | 28.1 |
实验用品:10%Na2CO3溶液、Fe屑、3molH2SO4、(NH4)2SO4、蒸馏水、无水乙醇。实验步骤流程如图所示:
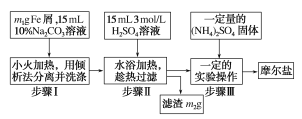
(1)步骤Ⅰ加入10%Na2CO3溶液的作用是__。
(2)下列情况适合倾析法的有__。
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤Ⅲ中加入(NH4)2SO4后要得到摩尔盐晶体,需要经过的实验操作包括加热蒸发、__、__。
(4)得到的晶体需要用乙醇洗涤的目的是__。
(5)已知摩尔盐晶体在100℃~110℃时分解,分解的产物中除固体外,还可能含有SO3(g)、SO2(g)及N2(g)。甲同学用如图所示装置设计实验,探究摩尔盐晶体加热分解时可能产生的气体产物。
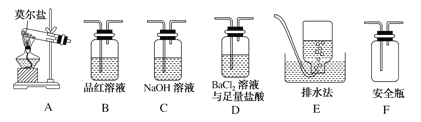
①甲同学的实验中,装置依次连接的合理顺序为:A→F→(____________)→(____________)→C→E。
②证明含有SO3的实验现象是__。
(6)为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成500mL溶液。通过测定NH4+设计实验装置如图所示。取25.00mL样品溶液进行该实验。
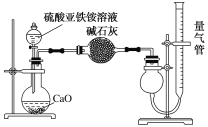
①该方案中量气管中最佳试剂是__。
a.水 b.饱和NaHCO3溶液 c.CCl4 d.饱和食盐水
②该方案中收集完气体并恢复至室温,读数前应进行的操作是__。
③设该样品中NH4+完全转化为NH3且忽略溶解损耗,测得NH3的体积为VL(已折算为标准状况下),则该摩尔盐样品中硫酸亚铁铵纯度为__(用含m、V的代数式表示,(NH4)2SO4·FeSO