题目内容
16.化学与生产、生活、社会密切相关,下列说法不正确的是( )| A. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| B. | 小苏打是制作面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | 蛋白质、淀粉、油脂等都能在人体内水解并提供能量 | |
| D. | 纯净的二氧化硅是现代光学及光纤制品的基本原料 |
分析 A、明矾中的铝离子水解,生成的氢氧化铝胶体具有净水作用,是物理吸附净水;
B、小苏打可以和酸反应生成二氧化碳、盐、水;
C、根据蛋白质、淀粉和油脂在人体内的水解产物来分析;
D、纯净的二氧化硅良好的折光性.
解答 解:A、明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的净化,但是不会具有消毒作用,故A错误;
B、小苏打可以和酸反应生成二氧化碳、盐、水,是制作面包等糕点的膨松剂,还是治疗胃酸(盐酸)过多的一种药剂,故B正确;
C、蛋白质在人体内水解为氨基酸,淀粉水解为葡萄糖,油脂水解为甘油和高级脂肪酸,故C正确;
D、纯净的二氧化硅良好的折光性,是现代光学及光纤制品的基本原料,故D正确.
故选A.
点评 本题考查明矾、小苏打和二氧化硅的性质和用途,难度不大,掌握二氧化硅的用途,是高频考点.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
4.已知:25℃时,Mg(OH)2的Ksp=5.61×10-12,MgF2的Ksp=7.42×10-11,下列判断正确的是( )
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25℃时,Mg(OH)2固体在20mL 0.01mol/L的氨水中的Ksp比在20mL0.01mol/L NH4Cl溶液中的Ksp小 | |
| D. | 25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2 |
11.下列图示与对应的叙述相符的是 ( )
| A. |  表示某吸热反应分别在有、无催化剂的情兄下反应过程中的能量变化 | |
| B. | 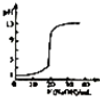 表示常温下,0.1 OOOmoi/LNaOH 溶液液滴定 20.00mL、0.0100/LHCl 溶液 所得到的滴定曲线 | |
| C. | 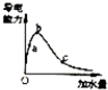 表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c>a>b | |
| D. | 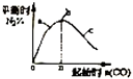 表示反应4CO+2NO2(g)?N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体识分数变化情况,由图可知NO2的转化率 c>b>a |
1.现有物质的量浓度均为0.1mol/L的溶液①NH3•H2O②CH3COOH③KHSO4.下列有关离子浓度分析一定不正确的是( )
| A. | 向①中逐滴加入少量②,$\frac{c(N{H}_{4}^{+})}{c(O{H}^{-})}$逐渐增大 | |
| B. | ①、③等体积混合后溶液中存在:NH4++H2O?NH3•H2O+H+ | |
| C. | ①、②任意比混合:c(CH3COO-)+c(OH-)=c(H+)+c(NH4+) | |
| D. | ①、③按体积比2:1混合:c(NH4+)>c(NH3•H2O)>c(SO42-)>c(OH-)>c(H+) |
8. X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )| A. | Z的氧化物对应的水化物一定是一种强酸 | |
| B. | 原子半径大小顺序是X>Y>Z | |
| C. | Y的单质比Z的单质更易与氢气反应 | |
| D. | Z的单质与Fe反应形成的化合物中,铁元素显+3价 |
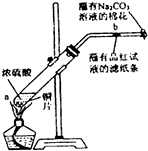
5. 用如图所示装置检验对应气体时,不能达到目的是( )
用如图所示装置检验对应气体时,不能达到目的是( )
 用如图所示装置检验对应气体时,不能达到目的是( )
用如图所示装置检验对应气体时,不能达到目的是( )| 生成的气体 | 试剂X | 试剂Y | |
| A | 电石与水反应制取的乙炔 | CuSO4溶液 | Br2的CCl4溶液 |
| B | 木炭与浓H2SO4加热制取的二氧化碳 | 饱和NaHCO3溶液 | 澄清石灰水 |
| C | CH3CH2Br与NaOH乙醇溶液共热制取的乙烯 | 水 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
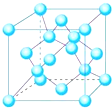 有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:
有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题: ,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答).
,YQ3中心原子的杂化类型为sp2杂化,除X外,其余元素的第一电离能由小到大顺序为B<C<O<N<F(元素符号回答). ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.