题目内容
7.某化学兴趣小组学生做浓硫酸性质的有关实验: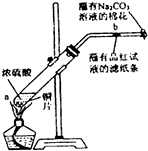
①在一支试管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上;
②在一小条蘸有品红试液的滤纸放入带有单孔橡皮塞的玻璃管中;
③塞紧试管口,在玻璃管口处缠放一团蘸有Na2CO3溶液的棉花;
④加热试管,观察现象.试回答下列问题:
(1)写出试管中发生反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)试管中的液体反应一段时间后,b处滤纸条的变化为滤纸褪色,待试管中反应停止后,给玻璃管放有蘸过品红试液的滤纸处微微加热,滤纸条的变化为滤纸重新变红.
(3)蘸有Na2CO3溶液棉花团作用是吸收多余SO2气体,防止污染空气.
(4)硫酸型酸雨的形成过程可用下列反应中的AB来表示(选填编号).
A.2SO2+O2$\stackrel{催化剂}{?}$2SO3 B.SO3+H2O═H2SO4 C.SO2+H2O2═H2SO4
(5)浓硫酸有许多重要性质,在与含有水分的蔗糖作用过程中,不能显示的性质是A(选填编号).
A.酸性 B.脱水性 C.强氧化性 D.吸水性.
分析 (1)铜和浓硫酸在加热条件下能发生反应,生成硫酸铜和二氧化硫、水;
(2)二氧化硫能使品红溶液褪色,但二氧化硫的漂白性不稳定,加热时会恢复原来的颜色;
(3)二氧化硫有毒,所以不能直接排空,二氧化硫能够与碳酸钠溶液反应;
(4)硫酸型酸雨的形成过程,利用浮尘等催化作用下把二氧化硫氧化为三氧化硫,溶于水形成硫酸;
(5)浓硫酸除了具有酸性外,浓硫酸还具有自己特殊的性质,如浓硫酸与含有水分的蔗糖作用过程中显示了它的吸水性、脱水性和强氧化性.
解答 解:(1)铜和浓硫酸在加热条件下能发生反应,浓硫酸具有强氧化性,被铜还原为二氧化硫,产物有生成的硫酸铜、二氧化硫和水,该反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)二氧化硫能和有色物质生成无色物质,二氧化硫能使品红溶液褪色,所以二氧化硫具有漂白性;但生成的无色物质不稳定,加热时会恢复原来的颜色.
故答案为:滤纸褪色;滤纸重新变红;
(3)二氧化硫有毒,所以不能直接排空,二氧化硫能够与碳酸钠溶液反应,所以试管Ⅱ管口塞一团浸有碳酸钠溶液的棉花的作用是吸收未反应的SO2气体,
故答案为:吸收多余SO2气体,防止污染空气;
(4)硫酸型酸雨的形成过程,利用浮尘等催化作用下把二氧化硫氧化为三氧化硫,溶于水形成硫酸,所以AB反应符合,
故答案为:AB;
(5)浓硫酸和含有水分的蔗糖作用,被脱水后生成了黑色的炭(碳化),并会产生二氧化硫. 反应过程分两步,浓硫酸吸收水,蔗糖(C12H22O11)在浓硫酸作用下脱水,生成碳和水(试验后蔗糖会变黑,黑的就是碳颗粒),这一过程表现了浓硫酸的吸水性和脱水性;脱水反应产生的大量热让浓硫酸和C发生反应生成二氧化碳和二氧化硫,这一过程表现了浓硫酸的强氧化性,所以浓硫酸与蔗糖的反应中不显示的为酸性,
故答案为:A.
点评 本题考查了浓硫酸的性质,题目难度中等,侧重考查铜与浓硫酸的反应及二氧化硫的检验,注意明确二氧化硫的漂白性与氯水漂白性的区别,试题有利于培养学生灵活应用基础知识的能力.

 酸碱中和滴定是中学化学中重要的定量实验之一.
酸碱中和滴定是中学化学中重要的定量实验之一.Ⅰ.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).
根据要求回答下列问题:
(1)配制250mL 0.040mol•L-1的盐酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为测定该苛性钠溶液的准确浓度,几次滴定消耗盐酸的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗盐酸溶液的体积(mL) | 20.05 | 20.00 | 22.10 | 19.95 |
②该苛性钠溶液的浓度为0.080 mol•L-1.
(3)若操作过程中未用盐酸润洗滴定管,对测定结果有怎样的影响?答:偏大(填“偏大”、“偏小”或“无影响”).
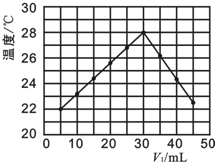
Ⅱ.在另一次实验中,研究性小组将V1 mL 1.0mol•L-1 HCl溶液和V2 mL 未知浓度的NaOH溶液均匀混合后,测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL).
(4)下列叙述中正确的是B
A.该实验的环境温度为22℃
B.当V1=40时,溶液中c(Na+)<c(Cl-)
C.NaOH溶液的浓度为1.0mol•L-1
D.保持其他条件不变,只将HCl改为CH3COOH
进行实验,也得到如图的实验结果.
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| B. | 小苏打是制作面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | 蛋白质、淀粉、油脂等都能在人体内水解并提供能量 | |
| D. | 纯净的二氧化硅是现代光学及光纤制品的基本原料 |
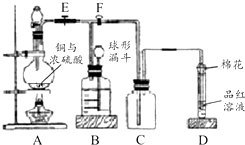 某课外兴趣小组为探究铜跟浓硫酸反应情况,用如图所示装置进行实验.
某课外兴趣小组为探究铜跟浓硫酸反应情况,用如图所示装置进行实验.
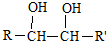 $\stackrel{HIO_{4}}{→}$RCHO+R′CHO
$\stackrel{HIO_{4}}{→}$RCHO+R′CHO . B→H的反应类型是取代反应.
. B→H的反应类型是取代反应.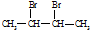 +2NaOH
+2NaOH CH3-C≡C-CH3+2NaBr+2H2O.
CH3-C≡C-CH3+2NaBr+2H2O.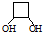 .
.