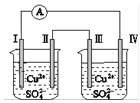
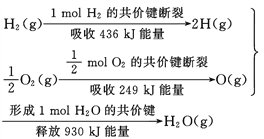
题目内容
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是( )
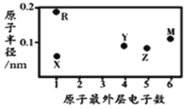
A.简单阳离子半径X最小
B.M的氢化物常温常压下为气体,分子间无氢键
C.最高价氧化物的水化物的酸性:Z<Y
D.X与Y可以形成平面形结构的分子,分子中存在极性共价键和非极性共价键
【答案】C
【解析】
同周期元素原子序数越大原子半径越小,同主族元素原子序数越大原子半径越大,根据图中规律不难得出X、Y、Z、M分别为H,C,N,S,R为Na。
A. 氢离子的离子半径最小,A项正确;
B. S的氢化物为H2S,常温常压下为气体,分子间无氢键,B项正确;
C. 元素的非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性C<N,所以酸性H2CO3<HNO3,C项错误;
D. H与C可以形成C2H4,C2H4为平面形结构的分子,分子中存在极性共价键和非极性共价键,D项正确;
答案选C。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】用方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2,还有少量Fe2O3,Al2O3等杂质) 制备PbSO4和Mn3O4的工艺流程如下:

已知:①浸取中主要反应:PbS+MnO2+4HCl=MnCl2+PbCl2+S+2H2O
②PbCl2难溶于冷水,易溶于热水;PbCl2 (s)+2Cl-(aq)![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Mn3O4是黑色不溶于水的固体,制备原理为:6MnCl2+O2+12NH3H2O=2Mn3O4↓+12NH4Cl+6H2O
④部分金属离子开始沉淀和沉淀完全的pH如下(开始沉淀的pH按金属离子浓度为0.1mol·L1计算)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀的pH | 7.6 | 2.7 | 4.0 | 7.7 |
沉淀完全的pH | 9.6 | 3.7 | 5.2 | 9.8 |
(1)“浸取”需控制温度在80℃左右,为加快酸浸速率,还可采用的方法是______。
(2)加入饱和NaCl溶液的目的是______。
(3)“浸取”过程中MnO2将Fe2+氧化的离子方程式为______。
(4)用MnCO3调节溶液pH的范围为______。
(5)“趁热抽滤”的目的是______。
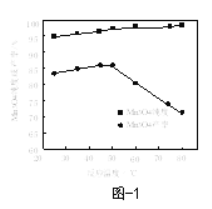
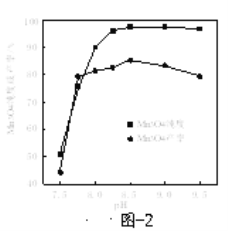
(6)已知:反应温度和溶液pH对Mn3O4的纯度和产率影响分别如图1、图2所示,请补充完整由滤液X制备Mn3O4的实验方案:______,真空干燥4小时得产品Mn3O4。(实验中须使用的试剂:氨水、空气)