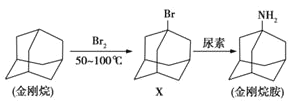
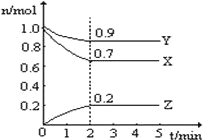
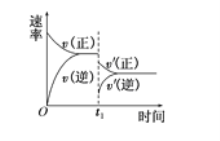
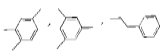
题目内容
【题目】根据下面的信息,下列叙述正确的是( )
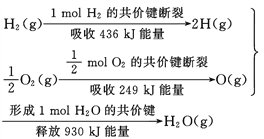
A. 2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)吸收能量为490 kJ
B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 1 mol H2(g) 跟0.5mol O2(g) 反应生成 1 mol H2O(l)释放能量为245 kJ
D. 2molH2O (g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低
【答案】D
【解析】A. 2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)放出的能量为490 kJ,A不正确;B. 化学反应中能量变化的大小与参加反应的反应物的质量成正比,B不正确;C. 1 mol H2(g) 跟0.5mol O2(g) 反应生成 1 mol H2O(g)释放能量为245 kJ,C不正确;D. 2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)的反应是放热反应,故2molH2O (g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低,D正确。本题选D。

【题目】X、Y、Z、W为短周期元素,若W原子的最外层电子数是其内层电子的![]() ,如图所示,下列说法不正确的是
,如图所示,下列说法不正确的是
X | Y | |
Z | W |
A.X元素的氢化物分子间可以形成氢键
B.Y元素的两种同素异形体常温下都是气体
C.阴离子半径从大到小的顺序为X>Y>Z>W
D.最高价氧化物对应的水化物的酸性:W>Z
【题目】请参照元素①-⑧在表中的位置,根据判断出的元素回答问题:
① | |||||||
② | ③ | ④ | |||||
⑤ | ⑥ | ⑦ | ⑧ |
(1)⑧原子的最外层电子的轨道表达式为___________________,关于它的最外层p亚层电子的说法错误的是_________。(填序号)
a. 能量相同 b.电子云形状相同
c. 自旋方向相同 d. 电子云伸展方向相同
(2)③和①组成的四核分子的化学式为___________,空间构型为_____________,属于_____分子(填“极性”或“非极性”)。
(3)比较④、⑤元素常见离子的半径大小(用化学式表示)______>_____;②、③ 两元素非金属性较强的是 ______(写元素符号),写出证明该结论的一个事实:___________________________ 。
(4)④、⑤元素形成的四原子化合物的电子式为 ___________ ;已知⑥元素的氧化物的熔点为2054℃,且以它为原料,可以通过电解的方法得到铝,据此推断⑥元素的氧化物为_________晶体(填“分子晶体”或“离子晶体”或“原子晶体”或“金属晶体”)。⑥元素的氧化物熔点______⑥元素的氯化物熔点(填“大于”“小于”“等于”),请解释其原因______________________________。