题目内容
【题目】N2H4是一种高效清洁的火箭燃料。0. 25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程式中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(g) ΔH=267 kJ·mol-1
N2(g)+H2O(g) ΔH=267 kJ·mol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=534 kJ·mol-1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
【答案】D
【解析】
A.该反应为放热反应,焓变为负值,ΔH<0,故A错误;
B.0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,故B错误;
C.该反应为放热反应,焓变为负值,ΔH<0,故C错误;
D.0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,热化学方程式为N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJmol-1,故D正确;
故选D。

【题目】含+6价铬的废水毒性强,对环境污染严重,工业上常利用化学原理把+6价铬转化为不溶性Cr(OH)3除去。
Ⅰ、SO2还原法:化工厂常用SO2处理含铬废水,其工艺流程如下图所示:
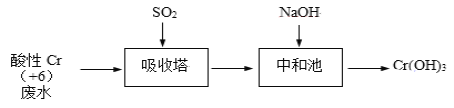
已知:Cr2O72- + H2O ![]() 2CrO42- + 2H+,吸收塔中 Cr2O72-与SO2反应如下:Cr2O72﹣(aq)+3SO2(g)+2H+(aq)═2Cr3+(aq)+3SO42﹣(aq)+H2O(l) ΔH = -1145 kJ/mol。
2CrO42- + 2H+,吸收塔中 Cr2O72-与SO2反应如下:Cr2O72﹣(aq)+3SO2(g)+2H+(aq)═2Cr3+(aq)+3SO42﹣(aq)+H2O(l) ΔH = -1145 kJ/mol。
(1)其他条件不变,研究吸收塔中pH对反应的影响。
pH | 2 | 4 | 6 |
Cr(+6)最大去除率 | 99.99%达排放标准 | 99.95%达排放标准 | 99.5%未达排放标准 |
时间 | 30 min | 35 min | 45 min |
①由上述数据获得的结论有_________。
②实际工业生产控制pH = ____左右。
③下列说法不合理的是_____。
a.该酸性含铬废水中一定含有CrO42-,pH越大其含量越高
b.其他条件不变,增大压强,吸收塔中反应的K增大,有利于除去Cr(+6)
c.理论上看,SO32-、Fe2+等也可以用于除去Cr(+6)
(2)其他条件不变,研究温度对Cr(+6)去除率的影响(如图所示)。
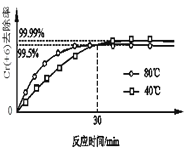
已知:30min前相同时间内,80℃的Cr(+6)去除率比40℃高,是因为30min前反应正向进行,温度高反应速率快反应物的转化率增大;试解释30min后80℃的Cr(+6)去除率低的原因:________。
Ⅱ、电解法处理:
工业上处理含Cr2O72-离子的酸性废水,采用往工业废水中加入适量的食盐,再用Fe为电极进行电解,将Cr2O72—离子还原为可溶性三价铬离子,再调pH使三价铬离子变为不溶性氢氧化物除去。
(1)加入食盐的目的是 _______;
(2)电解时阳极反应式为 _________。