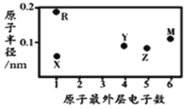
题目内容
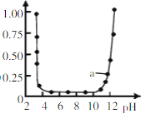
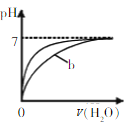
【题目】常温下,用0.1mol/L盐酸或NaOH溶液滴定体积均为20 mL,浓度均为0.1mol/L的MOH、HX溶液,滴定曲线如图所示。下列说法错误的是

A.两个滴定实验均可用酚酞作指示剂
B.常温下0.1mol/LMX溶液的pH<7
C.a点溶液中存在:c(X-)>c(HX)
D.b点溶液中存在:2c(MOH)+c(M+)+c(OH-)=c(H+)
【答案】A
【解析】
A.酚酞变色pH在8.2~10之间,滴定MOH时反应产生的盐MCl是强酸弱碱盐,恰好反应时溶液显酸性,应该选择酸性范围内变色的指示剂,不能使用酚酞作指示剂,A错误;
B.0.1mol/LHX的pH=2,而0.1mol/L MOH的pH<12,说明电离产生HX>MOH,则MX溶液中M+的水解程度大于X-的水解程度,溶液显酸性,溶液的pH<7,B正确;
C.用NaOH溶液滴定HX溶液,在a点时溶液为HX与NaX等浓度的混合溶液,a点溶液显酸性,说明HX电离程度大于X-的水解程度,所以c(X-)>c(HX),C正确;
D.b点时溶液我MCl与HCl等浓度的混合溶液,根据电荷守恒得c(M+)+c(H+)=c(OH-)+c(Cl-),根据物料守恒得2[c(MOH)+c(M+)]=c(Cl-),相加得2c(MOH)+c(M+)+c(OH-)=c(H+),D正确;
故合理选项是A。

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目