题目内容
【题目】在100℃时,将0.1mol的四氧化二氮气体充入1 L抽空的密闭容器中,发生反应,隔一定时间对该容器内的物质进行分析,得到如下数据:
浓度 时间(S) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L—1 | 0.1 | c1 | 0.05 | c3 | a | b |
c(NO2)/mol·L—1 | 0 | 0.06 | c2 | 0.12 | 0.12 | 0.12 |
(1)该反应的化学方程式为______________________,表中c2_____c3_____a______b(选填“>”、“<”、“==”)。
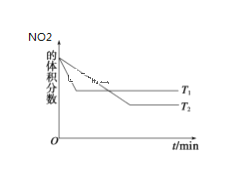
(2)20 s时四氧化二氮的浓度c1=____________mol·l—1依据图象可以判断该反应的 ΔH___0(填“>”或“<”)
【答案】N2O4![]() 2NO2 > = = 0.07 >
2NO2 > = = 0.07 >
【解析】
(1)四氧化二氮反应生成二氧化氮,其反应的化学方程式为N2O4![]() 2NO2,40s时四氧化二氮物质的量浓度为0.05 mol·L-1,改变量为0.05 mol·L-1,则二氧化氮物质的量浓度改变量为0.1 mol·L-1,60s二氧化氮改变量为0.12 mol·L-1,则四氧化二氮物质的量改变量为0.06 mol·L-1,此时四氧化二氮物质的量浓度为0.04 mol·L-1,60s以后已经达到平衡。
2NO2,40s时四氧化二氮物质的量浓度为0.05 mol·L-1,改变量为0.05 mol·L-1,则二氧化氮物质的量浓度改变量为0.1 mol·L-1,60s二氧化氮改变量为0.12 mol·L-1,则四氧化二氮物质的量改变量为0.06 mol·L-1,此时四氧化二氮物质的量浓度为0.04 mol·L-1,60s以后已经达到平衡。
(2)20 s时二氧化氮物质的量浓度改变量为0.06 mol·L-1,则四氧化二氮物质的量浓度改变量为0.03 mol·L-1,则此时四氧化二氮物质的量浓度c1=0.1 mol·L-1 – 0.03 mol·L-1 =0.07 mol·L-1,依据图象先拐先平衡,数字大,得出T1 > T2,从下到上,升温,二氧化氮体积分数变大,说明是正向移动,即升温正向移动,正向是吸热反应,即ΔH>0。
(1)四氧化二氮反应生成二氧化氮,其反应的化学方程式为N2O4![]() 2NO2,40s时四氧化二氮物质的量浓度为0.05 mol·L-1,改变量为0.05 mol·L-1,则二氧化氮物质的量浓度改变量为0.1 mol·L-1,60s二氧化氮改变量为0.12 mol·L-1,则四氧化二氮物质的量改变量为0.06 mol·L-1,此时四氧化二氮物质的量浓度为0.04 mol·L-1,60s以后已经达到平衡,因此表中c2>c3=a=b,故答案为:N2O4
2NO2,40s时四氧化二氮物质的量浓度为0.05 mol·L-1,改变量为0.05 mol·L-1,则二氧化氮物质的量浓度改变量为0.1 mol·L-1,60s二氧化氮改变量为0.12 mol·L-1,则四氧化二氮物质的量改变量为0.06 mol·L-1,此时四氧化二氮物质的量浓度为0.04 mol·L-1,60s以后已经达到平衡,因此表中c2>c3=a=b,故答案为:N2O4![]() 2NO2;>;=;=。
2NO2;>;=;=。
(2)20 s时二氧化氮物质的量浓度改变量为0.06 mol·L-1,则四氧化二氮物质的量浓度改变量为0.03 mol·L-1,则此时四氧化二氮物质的量浓度c1=0.1 mol·L-1 – 0.03 mol·L-1 =0.07 mol·L-1,依据图象先拐先平衡,数字大,得出T1 > T2,从下到上,升温,二氧化氮体积分数变大,说明是正向移动,即升温正向移动,正向是吸热反应,即ΔH>0,故答案为:0.07;>。

【题目】在如图所示装置中,观察到电流计指针偏转,M棒变细,N棒变粗,其中P为电解质溶液。由此判断M、N、P所代表的物质不可能是( )
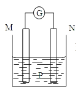
M | N | P | |
A | Zn | Cu | 稀硫酸 |
B | Fe | Cu | 硫酸铜溶液 |
C | Zn | Ag | 硝酸银溶液 |
D | Zn | Fe | 硝酸铜溶液 |
A.AB.BC.CD.D