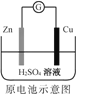
题目内容
【题目】下列说法中,可以证明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①1个N≡N键断裂的同时有3个H—H键形成
②N2、H2、NH3的分子数之比为1∶3∶2
③1个N≡N键断裂的同时有6个N—H键形成
④N2、H2、NH3的浓度不再变化
A. ①④ B. ②③ C. ①③ D. ②④
【答案】A
【解析】
可逆反应的平衡状态判断依据是“变量不变”一定平衡。
①.由方程式可知,每断裂1个N≡N的同时,一定有3个H-H键断裂,若同时有3个H-H形成,则说明v正=v逆,化学反应达到平衡状态,故①选;
②.题干未告知各物质的起始量以及转化率,无法判断达到平衡时N2、H2、NH3的分子数之比,故根据分子个数比无法判断反应是否达到平衡状态,故②不选;
③.由方程式可知,每断裂1个N≡N,一定会有6个N-H键形成,故无法判断是否达到平衡状态,故③不选;
④.当其它条件不变,反应中物质的浓度不再变化时,反应一定达到平衡状态,故④选;综上所述,可以证明该反应已达到平衡状态的是①④,故答案为A。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】工业上以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备金属镁的实验流程如下:
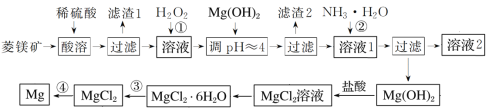
已知:一些金属离子转化为氢氧化物沉淀时溶液的pH如表所示
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
完全沉淀时 | 3.7 | 5.2 | 9.7 |
请回答:
(1)如果没有过程①,后果是:__________________________________。
(2)上述流程中被循环使用的物质是:____________。
(3)滤渣2的主要成分为:____________;溶液2中的主要溶质为:_____________。
(4)通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,为保证Mg2+沉淀完全,过程②中控制溶液的pH至少为________。(保留小数点后一位)(已知Mg(OH)2的Ksp=2×10-11,lg2=0.3)
(5)已知MgCl2·6H2O受热时发生水解:MgCl2·6H2O=Mg(OH)Cl+HCl↑+5H2O,过程③应该如何操作才能得到无水MgCl2?:_______________________________________________。
(6)写出过程④中发生反应的化学方程式:_____________________________________。
(7)为测定菱镁矿中铁的含量。称取12.5 g菱镁矿样品溶于过量的稀硫酸并完全转移到锥形瓶中,用0.010 mol·L—1H2O2溶液进行滴定。平行测定4组,消耗H2O2溶液的体积数据记录如下表所示。
实验编号 | 1 | 2 | 3 | 4 | 平均值 |
消耗H2O2溶液的体积/mL | 15.00 | 15.02 | 15.62 | 14.98 |
①根据表中数据,可计算出菱铁矿中铁的质量分数为__________%。(保留两位小数)
②H2O2溶液应装在__________ 滴定管中(填“酸式”或“碱式”)
③误差
a.其它操作均正常,滴定终点时仰视读数会导致所测结果_________。
b.滴定之前没有排除滴定中的气泡会导致所测结果_________。
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:
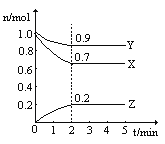
(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.36 | 0.48 | 0.50 | 0.50 |
0~50s内的平均反应速率v(N2)=__________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g)、B(g)所需的能量,用符号E表示,单位为kJ/mol。H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成1mol NH3过程中放出46kJ的热量。则N≡N的键能为_________kJ/mol。