题目内容
如图为配制100mL 0.2mol?L-1 NaCl溶液示意图.
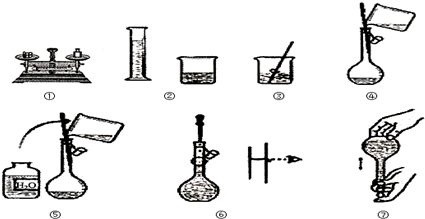
回答下列问题.
(1)①中称取NaCI质量为 克.
(2)玻璃棒在③、④两步中的作用分别是 、 .
(3)下列情况,对所配溶液浓度有何影响?(填偏高、偏低或无影响)
A.步骤⑤没有洗涤烧杯,直接加水至刻度.( )
B.步骤⑥观察液面时俯视.( )

回答下列问题.
(1)①中称取NaCI质量为
(2)玻璃棒在③、④两步中的作用分别是
(3)下列情况,对所配溶液浓度有何影响?(填偏高、偏低或无影响)
A.步骤⑤没有洗涤烧杯,直接加水至刻度.(
B.步骤⑥观察液面时俯视.(
考点:溶液的配制
专题:实验题
分析:(1)根据100mL 0.2mol?L-1 NaCl溶液中含有氯化钠的物质的量计算出需要氯化钠的质量,注意托盘天平的最小读数为0.1g;
(2)配制过程中,玻璃棒在溶解时通过搅拌加速溶解,转移溶液时需要使用玻璃棒引流;
(3)根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
(2)配制过程中,玻璃棒在溶解时通过搅拌加速溶解,转移溶液时需要使用玻璃棒引流;
(3)根据c=
| n |
| V |
解答:
解:(1)100mL 0.2mol?L-1 NaCl溶液中含有氯化钠的物质的量为:0.2mol/L×0.1L=0.02mol,需要氯化钠的质量为:58.5g/mol×0.02mol=1.17g,需要用托盘天平称量氯化钠的质量为1.2g,
故答案为:1.2;
(2)步骤③中为溶解氯化钠固体,通过玻璃棒的搅拌可以加速氯化钠的溶解;步骤④为移液操作,玻璃棒起到了引流的作用,可以避免液体流到容量瓶以外,
故答案为:搅拌;引流;
(3)A.步骤⑤没有洗涤烧杯,直接加水至刻度,会导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度浓度偏低,
故答案为:偏低;
B.步骤⑥观察液面时俯视,俯视定容,导致加入的蒸馏水低于容量瓶刻度线,配制的溶液溶液体积偏小,溶液浓度偏高,
故答案为:偏高.
故答案为:1.2;
(2)步骤③中为溶解氯化钠固体,通过玻璃棒的搅拌可以加速氯化钠的溶解;步骤④为移液操作,玻璃棒起到了引流的作用,可以避免液体流到容量瓶以外,
故答案为:搅拌;引流;
(3)A.步骤⑤没有洗涤烧杯,直接加水至刻度,会导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度浓度偏低,
故答案为:偏低;
B.步骤⑥观察液面时俯视,俯视定容,导致加入的蒸馏水低于容量瓶刻度线,配制的溶液溶液体积偏小,溶液浓度偏高,
故答案为:偏高.
点评:本题考查了配制一定物质的量浓度的溶液的方法,题目难度中等,试题基础性强,注重灵活性,试题侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力,该题的难点在于误差分析,注意明确误差分析的方法.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→O2.则下列说法中正确的是( )
| A、上述过程的氧化剂为H2O2 | ||
B、若上述过程中产生的氧气为1mol,则消耗的H2CrO4为
| ||
| C、上述过程中Cr(OH)3是反应物 | ||
| D、上述过程的氧化产物为H2CrO4 |
在一恒容的密闭容器中,A(g)+B(g)?C(g)的平衡体系中,若增大A的浓度而使平衡向右移动,当达到新的平衡时,则下列说法不正确的是( )
| A、A的平衡浓度一定比原来平衡时大 |
| B、B的平衡浓度一定比原来平衡时小 |
| C、C的百分含量可能比原来平衡时大 |
| D、A的转化率一定比原来平衡时大 |
给试管中某红色溶液加热,溶液颜色逐渐变浅,则原溶液可能是( )
①滴有石蕊的NH4Cl溶液 ②滴有石蕊的CO2溶液 ③滴有石蕊的H2SO4溶液
④滴有酚酞的氨水溶液 ⑤滴有酚酞的氢氧化钠溶液 ⑥滴有酚酞的饱和氢氧化钙溶液
⑦滴有酚酞的Na2CO3溶液 ⑧溶有SO2的品红溶液.
①滴有石蕊的NH4Cl溶液 ②滴有石蕊的CO2溶液 ③滴有石蕊的H2SO4溶液
④滴有酚酞的氨水溶液 ⑤滴有酚酞的氢氧化钠溶液 ⑥滴有酚酞的饱和氢氧化钙溶液
⑦滴有酚酞的Na2CO3溶液 ⑧溶有SO2的品红溶液.
| A、②④ | B、①③⑤⑦ |
| C、①④⑥⑧ | D、②④⑥ |
化学与生活密切相关,下列说法不正确的是( )
| A、葡萄糖可用于补钙药物的合成 |
| B、二氧化硫可广泛用于食品的漂白 |
| C、聚乙烯塑料制品可用于食品的包装 |
| D、次氯酸钠溶液可用于环境的消毒杀菌 |
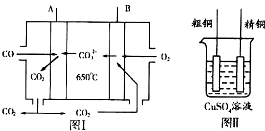 铜及其化合物在生活、生产中有广泛应用.请回答下列问题:
铜及其化合物在生活、生产中有广泛应用.请回答下列问题: