题目内容
1.92g Cu片与一定量的浓HNO3作用,当收集到NO2和NO气体共1.12L时(标准状况),金属铜恰好全部作用.则:
(1)反应中消耗HNO3 mol,转移电子 mol.
(2)用排水法收集生成的气体,最后气体的体积为 L(标准状况).
(3)向收集到的气体中通入 mL O2(标准状况)才能使水刚好充满整个集气容器.
(1)反应中消耗HNO3
(2)用排水法收集生成的气体,最后气体的体积为
(3)向收集到的气体中通入
考点:氧化还原反应的计算
专题:计算题
分析:n(Cu)=
=0.03mol,n(气体)=
=0.05mol,发生Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,结合电子守恒及原子守恒计算.
| 1.92g |
| 64g/mol |
| 1.12L |
| 22.4L/mol |
解答:
解:发生Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
(1)n(Cu)=
=0.03mol,n(气体)=
=0.05mol,由原子守恒可知,n(HNO3)=2n(Cu)+n(气体)=0.06mol+0.05mol=0.11mol;
由Cu元素的化合价变化可知,转移电子为0.03mol×(2-0)=0.06mol,
故答案为:0.11;0.06;
(2)设NO、NO2的物质的量分别为x、y,则
,解得x=0.005mol,y=0.045mol,
用排水法收集生成的气体,发生3NO2+H2O=2HNO3+NO,生成n(NO)=0.045mol×
=0.015mol,
则共收集NO为0.015mol+0.005mol=0.02mol,其标况下体积为0.02mol×22.4L/mol=0.448L,故答案为:0.448;
(3)能使水刚好充满整个集气容器,则Cu失去电子被硝酸得到转化为NO2和NO,NO2和NO与氧气反应,提供给氧气电子全部转化为硝酸,两个过程中,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,由电子守恒可知,需要氧气为
=0.015mol,标况下的体积为0.015mol×22.4L/mol=0.336L=336mL,故答案为:336.
(1)n(Cu)=
| 1.92g |
| 64g/mol |
| 1.12L |
| 22.4L/mol |
由Cu元素的化合价变化可知,转移电子为0.03mol×(2-0)=0.06mol,
故答案为:0.11;0.06;
(2)设NO、NO2的物质的量分别为x、y,则
|
用排水法收集生成的气体,发生3NO2+H2O=2HNO3+NO,生成n(NO)=0.045mol×
| 1 |
| 3 |
则共收集NO为0.015mol+0.005mol=0.02mol,其标况下体积为0.02mol×22.4L/mol=0.448L,故答案为:0.448;
(3)能使水刚好充满整个集气容器,则Cu失去电子被硝酸得到转化为NO2和NO,NO2和NO与氧气反应,提供给氧气电子全部转化为硝酸,两个过程中,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,由电子守恒可知,需要氧气为
| 0.03mol×(2-0) |
| 2×2 |
点评:本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,易错点为题(3),注意理解反应的实质,结合方程式利用原子守恒、电子守恒进行的计算,题目难度中等.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
下列有关溶液的叙述中,正确的是( )
| A、中和10mL 0.1mol?L-1醋酸与中和100mL 0.01mol?L-1的醋酸所需同种碱溶液的量不同 |
| B、常温下,等体积的pH=3的酸溶液和pH=11的碱溶液混合,混合后溶液的pH=7 |
| C、常温下,体积相等、pH相同的盐酸和硫酸溶液,两溶液溶质的物质的量浓度相等 |
| D、常温下,pH=3的甲酸溶液的c(H+)与pH=11的氨水溶液的c(OH-)相等 |
对于合成氨反应:3H2(g)+N2(g)?2NH3(g)△H<0的四个图示,描述不正确的是( )
A、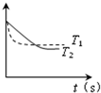 恒容条件下,已知该图中温度T1>T2,则纵轴可表示正反应速率 |
B、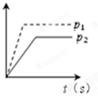 恒温下,已知该图中压强p1>p2,则纵轴可表示NH3的体积分数 |
C、 恒温、恒容下,该图中虚线表示开始充入2mol N2和3mol H2,实线表示开始充入1mol N2和3mol H2,则纵轴可表示H2的转化率 |
D、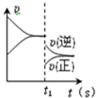 该图可表示平衡后,t1时在恒温恒压下充入He气时正、逆反应速率的变化曲线 |
造成目前环境污染的因素大体上可分为物理的、化学的与生物的三个方面,它们是造成环境质量下降的主要原因,其中化学物质约占( )
| A、30~40% |
| B、50~60% |
| C、70~80% |
| D、80~90% |