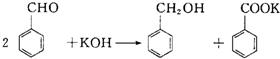
题目内容
12.标准状况下,气态分子断开1mol化学键的焓变称为键能.已知H-H、H-O和O=O键的键能△H分别为436kJ/mol、463kJ/mol和495kJ/mol,18g水蒸气变成液态水放出44kJ的热量,则氢气的燃烧热为( )| A. | 242.5kJ•mol-1 | B. | 286.5kJ•mol-1 | C. | 198.5kJ•mol-1 | D. | 573kJ•mol-1 |
分析 旧键断裂需要吸收能量,新键的生成会放出能量,△H=反应物的键能和-生成物的键能和,据此进行解答.
解答 解:氢气的燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l),又因为H-H、H-O和O=O键的键能△H分别为436kJ/mol、463kJ/mol和495kJ/mol,所以氢气的燃烧生成气态水时△H=436+495×$\frac{1}{2}$-463×2=-242.5kJ/mol,又18g水蒸气变成液态水放出44kJ的热量,所以H2(g)+$\frac{1}{2}$O2(g)=H2O(l),△H=-242.5-44=-286.5kJ•mol-1,故选:B.
点评 本题考查了反应热的计算,题目难度中等,注意氢气的燃烧热生成为液态水,明确化学键与化学反应中能量变化的关系是解题关键.

练习册系列答案
相关题目
3.某酸式盐NaHY的水溶液中存在c(OH-)>c(H+),则下列叙述正确的是( )
| A. | H2Y的电离方程式:H2Y?2H++Y2- | |
| B. | HY-的水解方程式:HY-+H2O?H3O++Y2- | |
| C. | 该酸式盐溶液中粒子浓度关系:c(Na+)>c(HY-)>c(OH-)>c(H2Y)>c(H+) | |
| D. | 该酸式盐溶液中离子浓度关系:c(Na+)>c(Y2-)>c(HY-) |
17.下列做法正确的是( )
| A. | 用手接触药品 | B. | 用嘴吹熄酒精灯火焰 | ||
| C. | 点燃氢气前一定要检验氢气的纯度 | D. | 将带有溶液的滴管平放在实验台上 |
4.下列关于混合物分离的方法中,能够分离汽油和水的是( )
| A. | 分液 | B. | 萃取 | C. | 蒸馏 | D. | 过滤 |
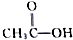 、
、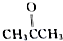 及
及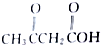 .根据上述事实推测A可能的构造式.
.根据上述事实推测A可能的构造式.