题目内容
【题目】Ⅰ.分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计,请回答下列问题:
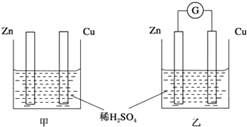
(1)以下叙述中,正确的是____。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为___________;乙为_________。
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:___________________________________。
Ⅱ.氢氧燃料电池,是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)氢氧燃料电池。
(1)如果是碱性燃料电池则负极反应方程式是:____________________。
(2)如果是酸性燃料电池则正极反应方程式是:___________________。
【答案】 C、D 化学能转化为热能 化学能转化为电能 Cu2++2e﹣![]() Cu H2-2e﹣+2OH﹣
Cu H2-2e﹣+2OH﹣![]() 2H2O O2+4e﹣+4H+
2H2O O2+4e﹣+4H+![]() 4H2O
4H2O
【解析】Ⅰ.(1)A.甲不能组成原电池,锌与稀硫酸之间发生置换反应,A错误;B.甲不能组成原电池,锌表面产生氢气,乙构成原电池,锌是负极,铜是正极,氢离子在铜电极表面产生气体,B错误;C.两烧杯中均消耗氢离子放出氢气,氢离子浓度均减小,所以溶液pH均增大,C正确;D.通过原电池的反应速率快,则产生气泡的速度甲中比乙中慢,D正确;E.乙的外电路中电流方向Zn←Cu,E错误,答案选CD;(2)甲不能构成原电池,乙是原电池,则变化过程中能量转化的形式主要是:甲为化学能转化为热能,乙为化学能转化为电能。(3)在乙实验中,如果把硫酸换成硫酸铜溶液,则铜离子在正极放电,所以铜电极的电极反应方程式为Cu2++2e-=Cu。
Ⅱ.(1)如果是碱性燃料电池,负极是氢气放电,则负极反应方程式为H2-2e-+2OH-=2H2O;(2)如果是酸性燃料电池,氧气在正极放电,则正极反应方程式是O2+4e-+4H+=4H2O。

 阅读快车系列答案
阅读快车系列答案