题目内容
【题目】某化工厂为了综合利用生产过程中的副产品CaSO4 , 与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程.回答下列问题: 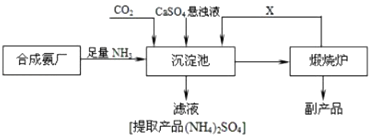
(1)工业合成氨所需氮气来自空气,常用物理方法获;该方法是;
(2)工业合成氨反应的化学方程式是
(3)沉淀池中发生反应的主要方程式是
(4)上述生产流程中,有关NH3的作用及说明正确的是 A.提供制各产品所需的氮元素
B.增大CO32﹣的浓度促进反应发生
C.作反应的催化剂
(5)可以循环使用的X是 . 从绿色化学和资源综合利用的角度说明上述流程的主要优点是 .
(6)写出硫酸钙的其它一种用途 .
【答案】
(1)蒸馏液态空气或者液化
(2)N2+3H2 ![]() 2NH3
2NH3
(3)CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4
(4)A、B
(5)CO2;生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成
(6)生产水泥或石膏
【解析】解:工业合成氨的反应原理为N2+3H2 ![]() 2NH3 , 将NH3和CO2通入沉淀池中并加入CaSO4 , 生成(NH4)2SO4和CaCO3 , 发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4 , CaCO3在煅烧炉中分解生成CO2和CaO,CO2可循环使用;(1)工业合成氨所需氮气来自空气,常用蒸馏空气或者液化的物理方法获得,所以答案是:蒸馏液态空气或者液化;(2)在高温、高压、催化剂条件下氮气和氢气发生化合反应生成氨气,反应方程式为N2+3H2
2NH3 , 将NH3和CO2通入沉淀池中并加入CaSO4 , 生成(NH4)2SO4和CaCO3 , 发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4 , CaCO3在煅烧炉中分解生成CO2和CaO,CO2可循环使用;(1)工业合成氨所需氮气来自空气,常用蒸馏空气或者液化的物理方法获得,所以答案是:蒸馏液态空气或者液化;(2)在高温、高压、催化剂条件下氮气和氢气发生化合反应生成氨气,反应方程式为N2+3H2 ![]() 2NH3 , 所以答案是:N2+3H2
2NH3 , 所以答案是:N2+3H2 ![]() 2NH3;(3)硫酸钙和二氧化碳、氨气、水反应生成碳酸钙和硫酸铵,反应方程式为CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4 , 所以答案是:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;(4)A.氨气、二氧化碳、硫酸钙和水反应生成硫酸铵,所以氨气提供制各产品所需的氮元素,故A正确; B.增大反应物浓度平衡正向移动,所以增大CO32﹣的浓度促进反应发生,故B正确;C.氨气是反应物,而不是催化剂,故C错误;故选AB;(5)在流程图中能作反应物和生成物的能循环利用,可以循环利用的物质有CO2 , 反应物能完全转化为生成物符合绿色化学理念且能充分利用资源,所以优点是生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成,所以答案是:CO2;生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成;(6)硫酸钙能用于生产水泥或石膏,所以答案是:生产水泥或石膏.
2NH3;(3)硫酸钙和二氧化碳、氨气、水反应生成碳酸钙和硫酸铵,反应方程式为CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4 , 所以答案是:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;(4)A.氨气、二氧化碳、硫酸钙和水反应生成硫酸铵,所以氨气提供制各产品所需的氮元素,故A正确; B.增大反应物浓度平衡正向移动,所以增大CO32﹣的浓度促进反应发生,故B正确;C.氨气是反应物,而不是催化剂,故C错误;故选AB;(5)在流程图中能作反应物和生成物的能循环利用,可以循环利用的物质有CO2 , 反应物能完全转化为生成物符合绿色化学理念且能充分利用资源,所以优点是生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成,所以答案是:CO2;生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成;(6)硫酸钙能用于生产水泥或石膏,所以答案是:生产水泥或石膏.

【题目】羰基硫(O=C=S)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。羰基硫的氢解反应和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H1=+7kJ/mol
H2S(g)+CO(g) △H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2
H2S(g)+CO2(g) △H2
已知反应中相关的化学键键能数据如下:
化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
E/kJ·mol-1 | 803 | 742 | 577 | 339 | 465 |
回答下列问题:
(1)在以上脱除COS的反应中,若某反应有1mol电子发生转移,则该反应吸收的热量为____kJ。
(2)已知热化学方程式CO(g)+H2O(g)![]() H2(g)+CO2(g) △H3,则△H3=_____kJ/mol。
H2(g)+CO2(g) △H3,则△H3=_____kJ/mol。
(3)某温度下,在某密闭容器中进行COS的氢解反应
①当反应达到限度后,增大容器的体积,则正反应速率_____(填“增大”“减小”或“不变”);
②当容器体积不变时,若起始时充入COS和H2的体积比为1:2,下列情形能表明反应达到平衡状态的是______。
a.气体密度不变 b.COS与H2浓度比不变
c.混合气体的平均相对分子质量不变 d.COS体积分数不变
③当容器体积不变时,若COS和H2的起始物质的量比为1:a,平衡后COS和H2的物质的量比为1:10a,则此温度下H2平衡转化率为______(用含a的式子表示)。
(4)羰基硫的氢解或水解反应能否设计成原电池_____(能或否),理由是________。
(5)用金属储氢材料(MH)、铂(Pt)、硫酸溶液组成的原电池可以使羰基硫脱硫处理。
①原电池的负极材料是____(填化学式)。
②写出原电池的正极反应式_________,正极周围溶液pH______(填“增大”“减小”或“不变”)。
③原电池工作时,硫酸溶液的作用是___________。


