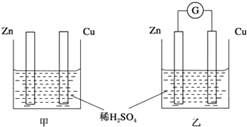
题目内容
【题目】已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现血红色. 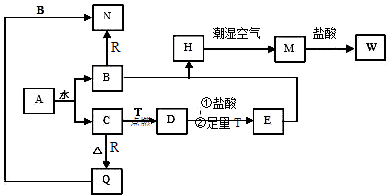
(1)写出下列物质的化学式:A , D , E , R , T .
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象: .
(3)按要求写方程式:B和R反应生成N的离子方程式:;M→W的离子方程式: .
【答案】
(1)Na2O2;Fe3O4;FeCl2;Al;Fe
(2)溶液中出现白色沉淀,在空气中迅速变成灰绿色,最终变成红褐色
(3)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;Fe(OH)3+3H+=Fe3++3H2O
【解析】解:A为淡黄色固体可知A为Na2O2 , D是具有磁性的黑色晶体判断为Fe3O4 , C是无色无味的气体是过氧化钠与水反应生成的氧气,B为NaOH,W溶液中加入KSCN出现血红色,说明W含有三价铁离子;T、R为两种常见的用途很广的金属单质,T在C中燃烧生成D为四氧化三铁,溶于盐酸生成溶液中含有亚铁离子和三价铁离子,加入过量铁反应生成亚铁离子,证明T为Fe;E为FeCl2 , H为Fe(OH)2 , M为Fe(OH)3 , W为FeCl3;金属R与B氢氧化钠反应说明R金属为Al,N为NaAlO2 , Q为Al2O3 , (1)由上述分析可知,A为Na2O2 , D为Fe3O4 , E为FeCl2 , R为Al,T为Fe,所以答案是:Na2O2;Fe3O4 ;FeCl2;Al;Fe;(2)B与E混和得到H为白色氢氧化亚铁沉淀,在潮湿空气中变成红褐色氢氧化铁沉淀的过程中,可能观察到的现象是:溶液中出现白色沉淀,在空气中迅速变成灰绿色,最终变成红褐色,所以答案是:溶液中出现白色沉淀,在空气中迅速变成灰绿色,最终变成红褐色;(3)B(NaOH)和R(Al)反应生成N(NaAlO2)的离子方程式为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;M(Fe(OH)3)和盐酸反应生成W(FeCl3)反应的离子方程式为Fe(OH)3+3H+=Fe3++3H2O; 所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;Fe(OH)3+3H+=Fe3++3H2O.

 走进文言文系列答案
走进文言文系列答案【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:固相法:2Li2SiO3+FeSO4![]() Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
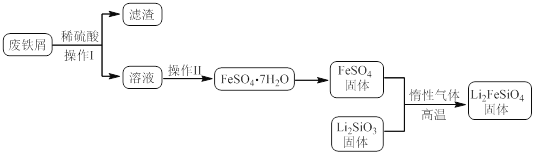
实验(二) Li2FeSiO4含量测定:
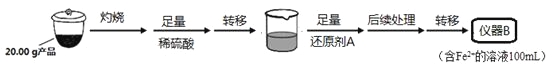
从仪器B中取20.00 mL溶液至锥形瓶中,另取0.2000 mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00 mL | 19.98mL | 21.38mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B ,仪器C 。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是 。
(3)操作Ⅱ的步骤 ,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需 。
(4)还原剂A可用SO2,写出该反应的离子方程式 ,此时后续处理的主要目的是 。
(5)滴定终点时现象为 ;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量 。(填“偏高”、“偏低”或“不变”)。
【题目】羰基硫(O=C=S)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。羰基硫的氢解反应和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H1=+7kJ/mol
H2S(g)+CO(g) △H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2
H2S(g)+CO2(g) △H2
已知反应中相关的化学键键能数据如下:
化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
E/kJ·mol-1 | 803 | 742 | 577 | 339 | 465 |
回答下列问题:
(1)在以上脱除COS的反应中,若某反应有1mol电子发生转移,则该反应吸收的热量为____kJ。
(2)已知热化学方程式CO(g)+H2O(g)![]() H2(g)+CO2(g) △H3,则△H3=_____kJ/mol。
H2(g)+CO2(g) △H3,则△H3=_____kJ/mol。
(3)某温度下,在某密闭容器中进行COS的氢解反应
①当反应达到限度后,增大容器的体积,则正反应速率_____(填“增大”“减小”或“不变”);
②当容器体积不变时,若起始时充入COS和H2的体积比为1:2,下列情形能表明反应达到平衡状态的是______。
a.气体密度不变 b.COS与H2浓度比不变
c.混合气体的平均相对分子质量不变 d.COS体积分数不变
③当容器体积不变时,若COS和H2的起始物质的量比为1:a,平衡后COS和H2的物质的量比为1:10a,则此温度下H2平衡转化率为______(用含a的式子表示)。
(4)羰基硫的氢解或水解反应能否设计成原电池_____(能或否),理由是________。
(5)用金属储氢材料(MH)、铂(Pt)、硫酸溶液组成的原电池可以使羰基硫脱硫处理。
①原电池的负极材料是____(填化学式)。
②写出原电池的正极反应式_________,正极周围溶液pH______(填“增大”“减小”或“不变”)。
③原电池工作时,硫酸溶液的作用是___________。