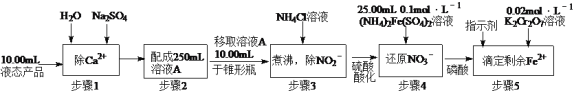
题目内容
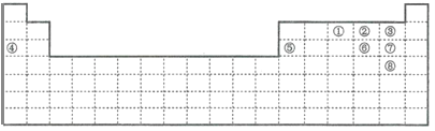
【题目】下图中的实线表示元素周期表的边界。①~⑧分别表示元素周期表中对应位置的元素。
(1)元素周期表体现了元素周期律。元素周期律的本质是________。在元素周期表中,元素的位置与结构的关系是______。
(2)在上表中画出金属区和非金属区的分界线_______
(3)上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对应水化物酸性最强的是________(填分子式)。
(4)④与⑥形成的化合物溶于水后,溶液的pH________7。原因________________(用离子方程式表示),若使其熔化,需破坏的作用力有________________。
(5)元素①的氢化物电子式为________________,该分子属于________晶体。
(6)⑥⑦两元素非金属性较强的是(写元素符号)________。写出能证明这一结论的一个实验事实____。
(7)⑤、⑦各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为____。
(8)⑦的氢化物的还原性比元素⑥的氢化物的还原性________(填“强”或“弱”)。
【答案】原子核外电子排布的周期性变化; 元素的周期数即为原子的电子层数,元素的主族序数即为原子的最外层电子数 ![]()
![]()
![]() >
> ![]()
![]() 、
、![]()
![]() 离子键
离子键 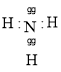 分子晶体 Cl 氯气通入
分子晶体 Cl 氯气通入![]() 溶液中产生淡黄色沉淀(合理即可)
溶液中产生淡黄色沉淀(合理即可) ![]() 弱
弱
【解析】
由元素在元素周期表中的位置可知,①为N,②为O,③为F,④为Na,⑤为Al,⑥为S,⑦为Cl,⑧为Br,然后利用元素及其单质、化合物的性质进行解答。
由元素在元素周期表中的位置可知,①为N,②为O,③为F,④为Na,⑤为Al,⑥为S,⑦为Cl,⑧为Br,
(1)元素周期律的本质为元素原子核外电子排布的周期性变化引起元素性质的周期性变化;在元素周期表中,元素的位置与结构的关系为元素的周期数即为原子的电子层数,元素的主族序数即为原子结构的最外层电子数;
故答案为:原子核外电子排布的周期性变化;元素的周期数即为原子的电子层数,元素的主族序数即为原子的最外层电子数;
(2)金属区和非金属区的分界线如图所示:
![]() ;
;
故答案为:![]() ;
;
(3)上述元素中N、O、F、Na、Al形成的简单离子核外电子排布相同,核电荷数越大,半径越小,则Al3+离子半径最小,Al3+核外电子层数为2,S2-、Cl-核外电子层数为3,Br-核外电子层数为4,因此上述元素所能形成的简单离子中半径最小的是Al3+;非金属元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,而同周期从左至右非金属性逐渐增强,同主族从上至下非金属逐渐减弱,因此Cl的非金属性最强,则其最高价氧化物对应水化物的酸性最强,为![]() ;
;
故答案为:![]() ;
;![]() ;
;
(4)④为Na,⑥为S,④与⑥形成的化合物为Na2S,其溶于水后,由于S2-水解使溶液呈碱性,则溶液的pH>7,S2-水解的离子方程式可表示为:![]()
![]() 、
、![]()
![]() ;Na2S为离子化合物,若使其熔化,需破坏的作用力为离子键;
;Na2S为离子化合物,若使其熔化,需破坏的作用力为离子键;
故答案为:>;![]()
![]() 、
、![]()
![]() ;离子键;
;离子键;
(5)①为N,N元素的氢化物为NH3,其为共价化合物,原子之间通过共用电子对形成相互作用力,则电子式为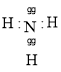 ;该分子属于分子晶体;
;该分子属于分子晶体;
故答案为: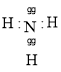 ;分子晶体;
;分子晶体;
(6)⑥为S,⑦为Cl,同周期元素从左至右非金属逐渐增强,则非金属性较强的为Cl;可从它们的非金属单质之间的置换反应比较元素非金属性的强弱,例如,可将氯气通入![]() 溶液中产生淡黄色沉淀,说明氯气的氧化性大于硫的氧化性,则非金属性:Cl>S;
溶液中产生淡黄色沉淀,说明氯气的氧化性大于硫的氧化性,则非金属性:Cl>S;
故答案为:Cl;氯气通入![]() 溶液中产生淡黄色沉淀(合理即可);
溶液中产生淡黄色沉淀(合理即可);
(7)⑤为Al,⑦为Cl,其最高价氧化物对应的水化物分别为Al(OH)3、HClO4,二者发生酸碱中和反应,反应的离子方程式为![]() ;
;
故答案为:![]() ;
;
(8)⑥为S,⑦为Cl,非金属性越强,其氢化物的还原性越弱,而非金属:Cl>S,则HCl的还原性比H2S的还原性弱;
故答案为:弱。