题目内容
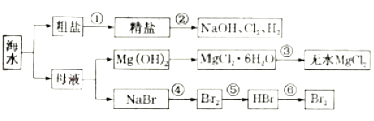
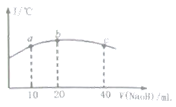
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子.若以它以及表2中的某些物质为原料,按图所示工艺流程进行生产,可制得轻质氧化镁。

若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:(注*Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去)。

(1)铁元素位于 第____族____区,其中Fe2+ 核外电子排布式为____,
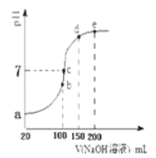
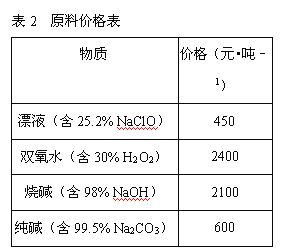
(2)在步骤②中加入的试剂X,最佳的选择是__________,写出步骤②中pH=1时所发生反应的离子方程式:__________;
(3)在步骤③中加入的试剂是____;之所以要控制pH=9.8,其目的是_______;
(4)已知在步骤⑤中发生的反应是____,写出步骤⑥的化学方程式_____。
【答案】VIII d [Ar]3d6 漂液NaClO 2Fe2++ClO﹣+2H+═2Fe3++Cl﹣+H2O 烧碱 使Mg2+以外的杂质离子转化成沉淀除去 水解反应 Mg(OH)2 ![]() MgO+H2O
MgO+H2O
【解析】
(1)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,根据构造原理写出亚铁离子核外电子排布式;
(2)要加入的X为双氧水或次氯酸钠,结合成本选择;
步骤②中pH=1时Fe2+被氧化生成Fe3+;
(3)要得到较为纯净的氧化镁,需将卤块中含有的杂质除掉,根据表格提供的信息可以看出,氢氧化锰在pH为9.8时沉淀完全;
(4)根据MgCO3的水解及Mg(OH)2的热稳定性分析。
(1)铁位于周期表中的第四周期,第Ⅷ族,d区,属于过渡元素;铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,Fe2+在基态时,核外电子排布式为:[Ar] 3d6;
(2)要加入的X为双氧水或次氯酸钠,根据反应的原理可以看出,次氯酸钠作为氧化剂反应后生成氯化钠杂质,而过氧化氢生产的是水,且双氧水的价格高于漂液NaClO,所以加入漂液NaClO;
步骤②中pH=1时Fe2+被氧化生成Fe3+,所发生反应的离子方程式为2Fe2++ClO﹣+2H+═2Fe3++Cl﹣+H2O;
(3)要得到较为纯净的氧化镁,需将卤块中含有的杂质除掉,根据表格提供的信息可以看出,氢氧化锰在pH为9.8时沉淀完全,故要控制pH=9.8,所以本题答案为:氢氧化钠,使FeCl3、MnCl2都转化为Fe(OH)3、Mn(OH)2沉淀,而大部分MgCl2尚未转化为Mg(OH)2,仍以MgCl2留在滤液中,达到分离杂质的目的;
(4)步骤⑤反应的化学方程式为:MgCO3+H2O![]() Mg(OH)2+CO2↑,发生的反应是水解反应,步骤⑥是氢氧化镁受热分解生成氧化镁和水,反应的化学方程式为Mg(OH)2
Mg(OH)2+CO2↑,发生的反应是水解反应,步骤⑥是氢氧化镁受热分解生成氧化镁和水,反应的化学方程式为Mg(OH)2 ![]() MgO+H2O。
MgO+H2O。

 阅读快车系列答案
阅读快车系列答案【题目】有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
粒子代码 | X | Y | Z | W |
原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
![]() 原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含
原子核外比X原子多3个电子,A的原子结构示意图是 ______ 含![]() 的氧化物晶体中含有共价键数目为 ______
的氧化物晶体中含有共价键数目为 ______
![]() 与钙离子组成的化合物的电子式为 ______
与钙离子组成的化合物的电子式为 ______
![]() 完全燃烧放出的热量是
完全燃烧放出的热量是![]() ,写出Y燃烧的热化学方程式 ______
,写出Y燃烧的热化学方程式 ______
![]() 组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系
组成W的元素最高价氧化物对应的水化物甲有如图所示转化关系![]() 反应条件和其他物质已略
反应条件和其他物质已略![]()
![]()
![]() 写出丁在高温下与水反应的化学方程式 ______
写出丁在高温下与水反应的化学方程式 ______
![]() 组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。
组成W的元素的简单氢化物极易溶于水的主要原因是 ______ ,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为 ______ 。