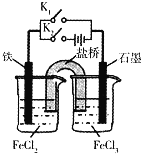
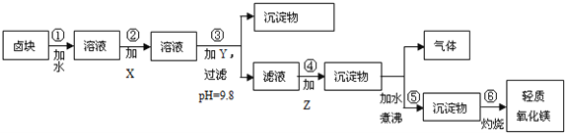
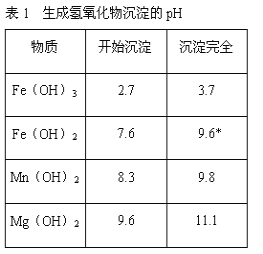
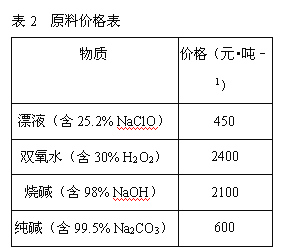
题目内容
【题目】在一密闭容器中,反应 aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则 ( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则 ( )
A.物质B的质量分数减小了B.平衡向逆反应方向移动了
C.平衡向正反应方向移动了D.a>b
【答案】C
【解析】
采用假设法分析,假设a=b,保持温度不变,将容器体积增加一倍,平衡不移动,A和B的浓度应均是原来的![]() 倍,但当达到新的平衡时,A的浓度是原来的40%,说明减小压强,平衡向正反应方向移动。
倍,但当达到新的平衡时,A的浓度是原来的40%,说明减小压强,平衡向正反应方向移动。
A、平衡向正反应方向移动,物质B的质量增大,混合物总质量不变,所以物质B质量分数增大,A错误;
B、平衡时A的浓度是原来的40%,小于原来的![]() 倍,说明平衡向正反应方向移动,B错误;
倍,说明平衡向正反应方向移动,B错误;
C、平衡时A的浓度是原来的40%,小于原来的![]() 倍,说明平衡向正反应方向移动,C正确;
倍,说明平衡向正反应方向移动,C正确;
D、增大体积,压强减小,平衡向正反应方向移动,说明正反应方向为气体体积增大的方向,即a<b,故D错误;
答案选C。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】I.用标准NaOH溶液滴定充满HCl的烧瓶(标况下,烧瓶容积为V L)做完喷泉实验后得到的稀盐酸(水充满整个烧瓶)以测定它的准确浓度,用酚酞作指示剂。请你回答下列问题:
(1)计算该盐酸的物质的量浓度为:_____。(保留三位有效数字)
(2)现有三种浓度的标准NaOH溶液,你认为最合适的是下列第_____种。
①5.00molL﹣1②0.500molL﹣1③0.0500molL﹣1
(3)若采用上述最合适浓度的标准NaOH溶液滴定,滴定时实验数据列表如下:
实验次数编号 | 待测盐酸体积(mL) | 滴入NaOH溶液体积(mL) |
1 | 10.00 | 8.48 |
2 | 10.00 | 8.52 |
3 | 10.00 | 8.00 |
求这种待测稀盐酸的物质的量浓度c(HCl)=_____。与理论计算值比较,造成的误差的原因可能是哪些下列操作导致的_____
①滴定前平视,滴定终了俯视
②滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡
③滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗
④看到颜色变化后立即读数 ⑤洗涤锥形瓶时,误把稀食盐水当做蒸馏水进行洗涤
II.测定绿矾FeSO4·xH2O中结晶水含量
Ⅰ.准确称量27.8 g绿矾样品,配成250 mL溶液;
Ⅱ.量取25.00 mL所配制的溶液于锥形瓶中;
Ⅲ.用硫酸酸化的0.100 0 mol·L1 KMnO4溶液滴定至终点;
Ⅳ.重复操作3次,消耗KMnO4溶液的体积分别为20.02 mL、24.98 mL、19.98 mL。
(1)判断达到滴定终点时的实验现象是_____。
(2)根据实验记录,计算绿矾化学式中结晶水数目x=__________。