题目内容
13.(1)气体化合物A分子式可表示为OxFy,已知同温同压下10mL A受热分解生成15mL O2和10mL F2,则A的化学式为O3F2(2)氯气与NaOH溶液吸收的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O
(3)实验室配制500ml 0.1mol•L-1的Na2CO3溶液,回答下列问题:
(a)应用托盘天平称取碳酸钠粉末5.3 g.
(b)配制时应选用的仪器有500ml容量瓶,托盘天平、烧杯、药匙、玻璃棒、胶头滴管.
(c)若实验时遇到下列情况,所配溶液的浓度偏大的是E.
A、加水定容时超过刻度线,又吸出少量水至刻度线;
B、忘记将洗涤液转入容量瓶;
C、容量瓶洗涤后内壁有水珠而未作干燥处理;
D、称量碳酸钠粉末时左盘放砝码,右盘放药品;
E、定容时俯视刻度线.
分析 (1)相同条件下,气体体积之比等于物质的量之比,根据原子守恒确定A的化学式;
(2)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水.
(3)(a)根据n=C•V和m=n•M来计算;
(b)根据配制溶液的实验操作过程选择所需的仪器;
(c)分析操作对溶质物质的量、溶液体积的影响,根据c=$\frac{n}{V}$判断对所配溶液浓度的影响.
解答 解:(1)同温同压下10mL A受热分解生成15mL O2和10mL F2,则A、O2、F2的物质的量之比=10:15:10=2:3:2,分解方程式为2OxFy$\frac{\underline{\;\;△\;\;}}{\;}$3O2+2F2,由原子守恒可知,A化学式为O3F2,故答案为:O3F2;
(2)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH-═Cl-+ClO-+H2O,故答案为:Cl2+2OH-═Cl-+ClO-+H2O.
(3)(a)配制500ml 0.1mol•L-1的Na2CO3溶液需要的Na2CO3的物质的量n=C•V=0.5L×0.1mol•L-1=0.05mol,质量m=n•M=0.05mol×106g/mol=5.3g,
故答案为:5.3;
(b)操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所用仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管、药匙,
故答案为:玻璃棒、胶头滴管;
(c)A、加水定容时超过刻度线,又吸出少量水至刻度线,则吸出的溶液中含有溶质,故导致浓度偏低,故A不选;
B、忘记将洗涤液转入容量瓶,会导致溶质损失,则浓度偏低,故B不选;
C、若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故C不选;
D、称量药品时,砝码错放在左盘,会导致药品的质量偏小,则所配溶液的浓度偏低,故D不选;
E、定容时俯视刻度线,则溶液体积偏小,浓度偏高,故E选.
故选E.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案 ,其一氯代物(C18H13Cl)同分异构体数目为( )
,其一氯代物(C18H13Cl)同分异构体数目为( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ⑦ | ④ | ||||
| 4 | ② |
(1)下列元素分别是①Na(填元素符号,下同),其中化学性质最不活泼的是Ar.
(2)⑥元素的氢化物是
 (填电子式),该氢化物在常温下与②发生反应的化学方程式为2K+2H2O=2KOH+H2↑.
(填电子式),该氢化物在常温下与②发生反应的化学方程式为2K+2H2O=2KOH+H2↑.(3)⑦元素与①元素形成的化合物是NaC(填化学式),高温下灼烧该化合物时,火焰呈黄色.
| 反应时间/min | n(CH3OH)/mol | n(CH3OCH3)/mo |
| 0 | 2.05 | 0 |
| t1 | 0.6 | |
| t2 | 0.05 |
| A. | 反应在t2 min时v正≠v逆 | |
| B. | 反应达到平衡时,放出的热量为50 kJ | |
| C. | 反应在t1 min内的平均速率为v(CH3OH)=$\frac{0.6}{{t}_{1}}$mol•L-1•min-1 | |
| D. | 若反应达到平衡后,缩小容器体积,$\frac{c(C{H}_{3}OC{H}_{3})}{c(C{H}_{3}OH)}$变大 |
①光气(COCl2) ②六氟化硫 ③HCHO ④三氟化硼 ⑤PCl3 ⑥PCl5 ⑦NO2 ⑧二氟化氙 ⑨N2 ⑩CH4.
| A. | ⑥⑦⑨ | B. | ①⑤⑨ | C. | ①④⑤⑦ | D. | ①④⑤⑨ |
| A. | 分离、提纯→确定分子式→确定实验式→确定结构式 | |
| B. | 分离、提纯→确定实验式→确定分子式→确定结构式 | |
| C. | 分离、提纯→确定结构式→确定实验式→确定分子式 | |
| D. | 确定分子式→确定实验式→确定结构式→分离、提纯 |
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 7种 |
| A. | Q1=Q2 | B. | Q1>Q2 | C. | Q1<Q2 | D. | 无法判断 |
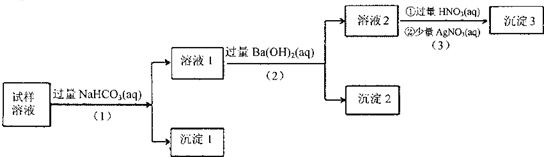
已知:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
| A. | 沉淀2放置在空气中,若质量增加,试样中肯定存在SO32- | |
| B. | 试样溶液中加人稍过量的NH4C1溶液能得到与沉淀1成分相同的物质 | |
| C. | 上述流程步骤(1)(2)(3)的顺序改为(3)(2)(1),可能会获得相同的实验现象 | |
| D. | 试样溶液中肯定存在A102-、Cl-,其中Na+、K+至少存在1种 |