题目内容
4.下列各组顺序的排列正确的是( )| A. | 金属性:Li<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性:H2SO4<H2CO3<HNO3 | D. | 沸点:H2O>H2S>H2Se |
分析 A.Mg、Al同周期,原子序数大的金属性弱;
B.非金属性越强,气态氢化物越稳定;
C.非金属性越强,最高价氧化物对应水化物的酸性越强;
D.水中含氢键,沸点最高,而H2S、H2Se中相对分子质量大的沸点高.
解答 解:A.Mg、Al同周期,原子序数大的金属性弱,则金属性为Li<Al<Mg,故A错误;
B.非金属性Cl>S>P,气态氢化物的热稳定性为HCl>H2S>PH3,故B正确;
C.非金属性N>S>C,最高价氧化物对应水化物的酸性为H2CO3<H2SO4<HNO3,故C错误;
D.水中含氢键,沸点最高,而H2S、H2Se中相对分子质量大的沸点高,则沸点为H2O>H2Se>H2S,故D错误;
故选B.
点评 本题考查元素周期表和元素周期律的综合应用,为高频考点,把握元素的性质比较、元素周期律的应用为解答的关键,侧重规律性知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了4个氧原子构成的氧分子O4,并用质谱仪器探测到了它是一种存在时间很短的化学物质.该氧分子具有空间对称结构,下列关于该氧分子的说法正确的是( )
| A. | 是一种新的化合物 | B. | 可能含有极性键 | ||
| C. | 与O2都是由氧元素构成的单质 | D. | 在自然界中能稳定存在 |
15.下列反应不可能作为原电池工作时发生的反应的是( )
| A. | Cu+2AgNO3═Cu(NO3)2+2Ag | B. | 2Fe+O2+2H2O═2Fe(OH)2 | ||
| C. | NaOH+HCl═NaCl+H2O | D. | 2H2+O2═2H2O |
12.短周期中的主族元素M、R(M、R代表元素符号)形成的简单离子M2-与R+的核外电子数之和为20,下列说法中,正确的是( )
| A. | M原子所含质子数一定大于R原子所含质子数 | |
| B. | M、R两种元素结合形成的化合物中不可能含有共价键 | |
| C. | M2-与R+的电子层结构不可能相同 | |
| D. | M一定存在同素异形体 |
19.常言“真金不怕火炼”从化学的角度对这句话的理解正确的是( )
| A. | 金在高温下发生了钝化 | B. | 金越炼硬度越大 | ||
| C. | 金的化学性质稳定,不易变质 | D. | 金的硬度大,高温下难于变形 |
9.化学能与热能、电能等能相互转化,下列说法正确的是( )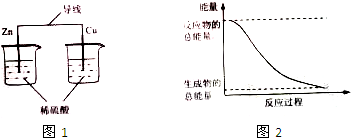

| A. | 图1所示的装置能将化学能转变为电能 | |
| B. | 图2所示的反应为吸热反应 | |
| C. | 化石燃料是可再生能源,燃烧时将化学能转变为热能 | |
| D. | 化学反应中能量变化的主要原因是化学键的断裂与生成 |
13.下列各组原子,彼此性质一定相似的是( )
| A. | 外围电子分别是1s2与2s2的元素 | |
| B. | M层上有两个电子与N层上有两个电子的元素 | |
| C. | 2p上有一个未成对电子与3p上有一个未成对电子的元素 | |
| D. | L层上有一个空轨道和M层的p轨道上有一个空轨道的元素 |
 CH2=CHCOOCH2CH3+H2O,该反应的类型是取代反应;
CH2=CHCOOCH2CH3+H2O,该反应的类型是取代反应;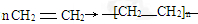 ;
;
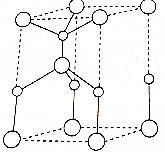 利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,如图为其晶胞结构水土,则每个晶胞中含有B原子的个数为2,该功能陶瓷的化学式为BN.
利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,如图为其晶胞结构水土,则每个晶胞中含有B原子的个数为2,该功能陶瓷的化学式为BN.