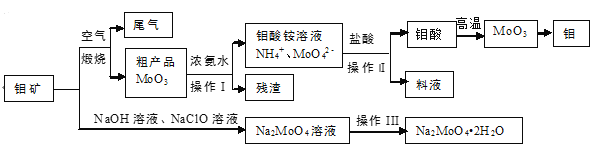
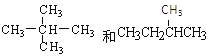题目内容
【题目】氢是人们公认的清洁能源,作为低碳和零碳能源正在脱颖而出,氢的获得及以氢为原料的工业生产工艺成为科技工作者研究的重要课题。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率与温度的变化如图所示:
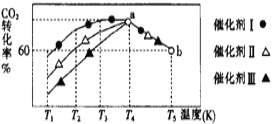
催化效果最好的是催化剂_____________(选填“Ⅰ”“Ⅱ”或“Ⅲ”),该反应在a点达到平衡状态,a点的转化率比b点的高,其原因是______________________________________________________。
②甲醇(CH3OH)燃料电池(NaOH溶液介质)的负极电极反应式 ___________。
(2)利用CO和水蒸气可生产H2,反应的化学方程式:CO(g)+H2O(g)![]() CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中进行如下反应,得到三组数据如下表所示:
CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中进行如下反应,得到三组数据如下表所示:

①该反应的正反应为___________反应(选填“放热”或“吸热” )。
②900℃时,达到平衡时的反应速率v(H2O)=____________,达到平衡时c(H2)=__________(保留2位小数)。
(3)利用废弃的H2S的热分解可生产H2:2H2S(g)![]() 2H2(g)+S2(g)。现将0.20 mol H2S(g)通入到某恒压(压强p=a MPa)密闭容器中,在不同温度下测得H2S的平衡转化率如下图所示:
2H2(g)+S2(g)。现将0.20 mol H2S(g)通入到某恒压(压强p=a MPa)密闭容器中,在不同温度下测得H2S的平衡转化率如下图所示:
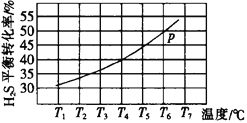
已知:对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数。 温度为T4℃时,该反应的平衡常数Kp=___________(用a的代数式表示)。
【答案】I 该反应为放热反应,温度升高,平衡逆向进行 CH3OH-6e-+8OH-=CO32-+6 H2O 放热 0.17 mol·L-1·min-1 0.50 mol·L-1 2a/27
【解析】
根据图像显示随温度变化,三种催化剂条件下,CO2的转化率变化趋势分析解答;根据化学平衡计算中,平衡前、平衡时、平衡后三段式分析解答计算。
(1) ①从图像中可知,在催化剂I的作用下,CO2的转化率是最高的,所以催化剂I的催化效果是最好的;该反应在a点达到平衡状态,a点的转化率比b点的高,是由于该反应为放热反应,温度升高,平衡吸热反应方向移动;
故答案为:催化剂I;该反应为放热反应,温度升高,平衡逆向进行;
②甲醇(CH3OH)燃料电池(NaOH溶液介质)的条件下,即甲醇在碱性条件下失去电子,生成CO32-和水,所以负极电极方程式为:CH3OH-6e-+8OH-=CO32-+6 H2O;
故答案为:CH3OH-6e-+8OH-=CO32-+6 H2O;
(2) ①从表格数据中可看出,温度升高,CO的转化率降低,即温度升高,反应向逆反应方向移动,温度升高向吸热方向移动,所以该反应的正反应方向是放热反应;
故答案为:放热;
②根据方程式可知,900℃时,达到平衡时CO的转化率为![]() ,即CO反应了1mol,推断出H2O反应了1mol,v(H2O)=
,即CO反应了1mol,推断出H2O反应了1mol,v(H2O)=![]() =
=![]() =0.17 mol·L-1·min-1;根据反应方程式中的化学计量数与物质的量关系可知,平衡时,生成H21mol,所以c(H2)=
=0.17 mol·L-1·min-1;根据反应方程式中的化学计量数与物质的量关系可知,平衡时,生成H21mol,所以c(H2)=![]() =0.5mol/L;
=0.5mol/L;
故答案为:0.17 mol·L-1·min-1 ,0.5mol/L;
(3)根据反应2H2S(g)![]() 2H2(g)+S2(g)
2H2(g)+S2(g)
初始状态 0.2mol 0 0 恒压压强为aMpa
T4时转化 0.2mol×40% 0.08mol 0.04mol
T4时容器
中剩余 0.12mol 0.08mol 0.04mol
容器内各
组分分压 ![]() MPa
MPa ![]() MPa
MPa ![]() MPa
MPa
即反应的平衡常数Kp=![]() =
=![]() =
=![]() ;
;
故答案为:![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】天然气是一种清洁能源和重要化工原料。
(1)下列事实能说明CH4分子呈正四面体结构的是___(填字母)。
A.CH4分子的4个C—H共价键键长相等
B.CH4分子中每个键角都是109°28′
C.CH2F2没有同分异构体
D.CCl4的沸点高于CH4的
(2)甲烷与下列烃的通式相同的是___(填字母)。

(3)已知断裂几种化学键要吸收的能量如下:
化学键 | C—H | O=O | C=O | H—O |
断裂1mol键吸收的能量/kJ | 415 | 497 | 745 | 463 |
16gCH4在O2中完全燃烧生成气态CO2和气态水时___(填吸收”或放出”)约___ kJ热量。
(4)天然气/空气燃料电池中,若KOH为电解质,负极反应式为___。等质量的甲烷分别以稀硫酸、KOH溶液为电解质溶液完全放电时,理论上提供的电能之比为___。
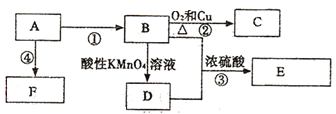
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。