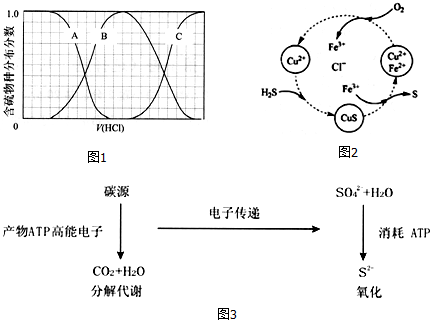
题目内容
9. (1)可正确表示原子轨道的是:AC.
(1)可正确表示原子轨道的是:AC.A.2sB.2dC.3pD.3f
(2)镓(Ga)原子序数为31,写出其基态原子的电子排布式:1s22s22p63s23p63d104s24p1.
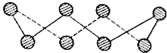
(3)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是sp3.
(4)用“>”“<”“=”填空:
第一电离能的大小:Mg>Al;熔点的高低:KCl<MgO.
(5)NO3-的空间构型为平面三角形(用文字描述).
(6)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是C.CO与N2结构相似,CO分子内σ键与π键个数之比为1:2.
分析 (1)第二能层有s、p轨道,第三能层有s、p、d轨道;
(2)Ga与Al同主族相邻,原子序数相差第四周期容纳元素种数;结合能量最低原理书写核外电子排布式;
(3)由S8的结构可知,每个S原子形成2个σ键、含有2对孤电子对,杂化轨道数目为4;
(4)Mg原子3s能级容纳2个电子,为全满稳定状态,能量较低,第一电离能高于同周期相邻元素;
离子电荷越大、离子半径越小,晶格能越大,离子晶体熔点越高;
(5)计算N原子价层电子对数、孤电子对数,进而确定其空间构型;
(6)Ni原子外围电子排布为3d84s2,未成对电子数为2,第二周期基态原子未成对电子数的外围电子排布为2s22p2或2s22p4,同周期自左而右电负性增大,故未成对电子数与Ni相同且电负性最小的元素是C;
CO与N2结构相似,二者互为等电子体,故CO结构式为C≡O.
解答 解:(1)第二能层有s、p轨道,第三能层有s、p、d轨道,故存在2s、3p原子轨道,不存在2d、3f原子轨道,故选:AC;
(2)Ga与Al同主族相邻,原子序数相差第四周期容纳元素种数,故Ga的原子序数为13+18=31,其核外电子排布为:1s22s22p63s23p63d104s24p1,故答案为:31;1s22s22p63s23p63d104s24p1;
(3)由S8的结构可知,每个S原子形成2个σ键、含有2对孤电子对,杂化轨道数目为4,S原子采取sp3杂化,故答案为:sp3;
(4)Mg原子3s能级容纳2个电子,为全满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能Mg>Al;
Mg2+、O2-离子电荷比K+、Cl-离子电荷多,其Mg2+、O2-离子半径小,故MgO晶格能比KCl的晶格能大,故熔点KCl<MgO,
故答案为:>;<;
(5)NO3-中N原子孤电子对数=$\frac{5+1-2×3}{2}$=0,价层电子对数=3+0=3,故为平面三角形,故答案为:平面三角形;
(6)Ni原子外围电子排布为3d84s2,未成对电子数为2,第二周期基态原子未成对电子数的外围电子排布为2s22p2或2s22p4,同周期自左而右电负性增大,故未成对电子数与Ni相同且电负性最小的元素是C;
CO与N2结构相似,二者互为等电子体,故CO结构式为C≡O,分子内σ键与π键个数之比为1:1,故答案为:C;1:2.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化方式判断、电离能、晶体类型与性质、微粒构型判断、等电子体等,需要学生具备扎实的基础,难度中等.

| A. | H2O | B. | 溴水 | ||
| C. | 新制Cu(OH)2 | D. | 酸性高锰酸钾溶液 |
| A. | 做菜时用适量的食盐、味精和醋调味 | |
| B. | 把三聚氰胺添加到牛奶中 | |
| C. | 把发霉的大米淘净后做饭 | |
| D. | 把色彩鲜艳的着色剂添加到婴儿食品中 |
| A. | 放电时,CH3OH参与反应的电极为正极 | |
| B. | 放电时,负极反应为:CH3OH-6e-+8OH-═CO32-+6H2O | |
| C. | 充电时,电解质溶液的pH逐渐增大 | |
| D. | 放电时,每通入标况下11.2L O2完全反应转移电子数为1mol |
| A. | Zn+HNO3(稀)→ | B. | Mg(OH)2+HNO3(稀)→ | C. | C+HNO3(浓)→ | D. | Cu+HNO3(浓)→ |