题目内容
4.甲醇、空气和强碱溶液做电解质的手机燃料电池中所发生的反应为:2CH3OH+3O2+4OH-2CO32-+6H2O,下列有关说法正确的是( )| A. | 放电时,CH3OH参与反应的电极为正极 | |
| B. | 放电时,负极反应为:CH3OH-6e-+8OH-═CO32-+6H2O | |
| C. | 充电时,电解质溶液的pH逐渐增大 | |
| D. | 放电时,每通入标况下11.2L O2完全反应转移电子数为1mol |
分析 该燃料电池中放电时,负极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,电极反应式为O2+2H2O+4e=4OH-,充电时阴阳极上电极反应式与放电时负极、正极上电极反应式正好相反,据此分析解答.
解答 解:A.放电时,甲醇失电子发生氧化反应,所以甲醇参与反应的电极是负极,故A错误;
B.放电时,负极上甲醇失电子发生氧化反应,电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,故B正确;
C.充电时,电池反应式为2CO32-+6H2O=2CH3OH+3O2+4OH-,有氢氧根离子生成,所以溶液碱性增大,pH增大,故C正确;
D.标况下11.2L氧气物质的量是0.5mol,放电时,每通入标况下11.2L O2完全反应转移电子物质的量=0.5mol×4=2mol,故D错误;
故选BC.
点评 本题考查化学电源新型电池,为高频考点,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.下列各有机物在一定的条件下能发生消去反应的是( )
| A. | CH3Cl | B. | (CH3)3CCH2OH | C. | (CH3)3CCl | D. | 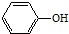 |
12.合理饮食是保证我们身体健康的前提,下列关于饮食的说法不正确的是( )
| A. | 水果、蔬菜含有丰富的维生素,若要减肥,每天只吃水果、蔬菜即可 | |
| B. | 米饭含有大量的淀粉,成人每天食用量不能超过500g | |
| C. | 要促进身体健康,饮食必须合理搭配 | |
| D. | 鸡蛋含有丰富的蛋白质,人体所需的蛋白质可由鸡蛋提供,青少年可适当多吃 |
19.下列关于实验现象的描述不正确的是( )
| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 | |
| B. | 用锌片做阳极,铁片做做阴极,电解氯化锌溶液,铁片表面出现一层锌 | |
| C. | 把要保护的金属与直流电负极相连,这种方法叫牺牲阳极的阴极保护法 | |
| D. | 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快 |
16.关于下列装置说法正确的是( )
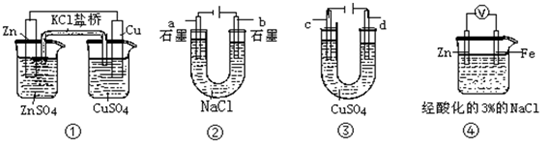

| A. | 装置①中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 装置②在电解开始阶段,b极附近溶液的pH增大 | |
| C. | 可以用装置③在银上镀铜,c极为银 | |
| D. | 装置④中一段时间后会有Fe(OH)2生成 |
14.下列说法中不正确的是( )
| A. | 碳原子与碳原子之间形成的σ键比π键重叠程度大,形成的共价键强 | |
| B. | 两个原子之间形成共价键时,最多有一个σ键 | |
| C. | 乙炔分子中,共含有4个σ键,1个π键 | |
| D. | 共价单键都属于σ键,π键只存在于双键或叁键中 |
15.1克SO2含有n个O原子,则阿佛加德罗常数可表示为( )
| A. | 64n | B. | n | C. | 32n | D. | n |
 (1)可正确表示原子轨道的是:AC.
(1)可正确表示原子轨道的是:AC.