题目内容
19.下列反应中,硝酸只表现氧化性的是( )| A. | Zn+HNO3(稀)→ | B. | Mg(OH)2+HNO3(稀)→ | C. | C+HNO3(浓)→ | D. | Cu+HNO3(浓)→ |
分析 硝酸只表现氧化性不表现酸性,说明硝酸中N元素都得电子化合价降低,据此分析解答.
解答 解:A.该反应中,硝酸中N元素部分化合价降低、部分化合价不变,所以硝酸体现氧化性和酸性,故A错误;
B.Mg(OH)2和稀HNO3中各元素的化合价在反应前后不变,生成硝酸铁,只表现酸性,故B错误;
C.在碳和浓HNO3的反应中,HNO3全部被还原,只表现氧化性,故C正确;
D.Cu+浓HNO3中N元素部分化合价降低,部分不变,化合价降低时表现氧化性,生成硝酸铜时表现酸性,故D错误;
故选C.
点评 本题考查了硝酸的性质,根据硝酸中元素化合价是否变化及生成物是硝酸盐还是氮的其它化合物来分析解答,题目难度不大.

练习册系列答案
相关题目
7.下列哪种物质所含的原子数与0.5mol H2O所含原子数相等( )
| A. | 0.6mol H2O2 | B. | 0.5mol H2SO4 | C. | 1mol HNO3 | D. | 1.5mol He |
14.下列说法中不正确的是( )
| A. | 碳原子与碳原子之间形成的σ键比π键重叠程度大,形成的共价键强 | |
| B. | 两个原子之间形成共价键时,最多有一个σ键 | |
| C. | 乙炔分子中,共含有4个σ键,1个π键 | |
| D. | 共价单键都属于σ键,π键只存在于双键或叁键中 |
4.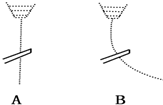 用一带静电的玻璃棒靠近A、B两种纯液体流,现象如图所示据此分析,A、B两种液体分子的极性正确的是( )
用一带静电的玻璃棒靠近A、B两种纯液体流,现象如图所示据此分析,A、B两种液体分子的极性正确的是( )
 用一带静电的玻璃棒靠近A、B两种纯液体流,现象如图所示据此分析,A、B两种液体分子的极性正确的是( )
用一带静电的玻璃棒靠近A、B两种纯液体流,现象如图所示据此分析,A、B两种液体分子的极性正确的是( )| A. | A是极性分子,B是非极性分子 | B. | A是非极性分子,B是极性分子 | ||
| C. | A、B都是极性分子 | D. | A、B都是非极性分子 |
11.天平左右两盘的烧杯中放有足量的盐酸,天平已达平衡,现向左盘烧杯中加入2.3g Na,若要使天平仍保持平衡,则应在右盘烧杯中加入( )
| A. | 2.3g Mg | B. | 2.7g Al | C. | 2.4 g Mg | D. | 2.8g Fe |
8.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 L 0.1 mol•L-1的氨水中含有的NH3•H2O分子数为0.1 NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2 NA | |
| C. | 标准状况下,2.24 L的二氯甲烷中含有的碳氯共价键的数目为0.2 NA | |
| D. | 一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1 NA |
9.有两种金属混合物4.0g,完全溶解于足量稀硫酸后放出氢气2.24L(标准状况),则此混合物可能的组成是( )
| A. | Cu和Mg | B. | Al和Fe | C. | Zn和Fe | D. | Al和Mg |
 图为乙醇分子的化学键示意图,请按要求回答问题:
图为乙醇分子的化学键示意图,请按要求回答问题: (1)可正确表示原子轨道的是:AC.
(1)可正确表示原子轨道的是:AC.